Железо является одним из наиболее распространенных элементов в Земной коре и входит в состав множества минералов. В химии железо обозначается символом Fe, по английскому названию "iron". Этот трансиционный металл обладает уникальными химическими свойствами и широко используется в различных отраслях промышленности и научных исследованиях. Железо характеризуется как магнитным, так и электропроводящим материалом, обладающим высокой пластичностью и прочностью.
Основные свойства железа включают его серую металлическую окраску, высокую плотность и кристаллическую структуру. Железо хорошо растворяется в кислотах, но не растворяется в воде. Оно подвержено коррозии, образуя ржавчину, поэтому часто покрывается защитным покрытием, таким как краска или заржавление.
Железо находит широкое применение в различных отраслях промышленности, включая машиностроение, строительство, электротехнику и металлургию. Оно используется для изготовления стальных конструкций, автомобилей, электродвигателей и электронных приборов. Железо также является необходимым элементом для организма человека, поскольку входит в состав гемоглобина и миоглобина, играя важную роль в транспортировке кислорода. Кроме того, железо является катализатором ряда химических реакций, таких как гидрогенирование и окисление.
В химии железо обладает большим числом реакций. Например, оно способно взаимодействовать с кислородом воздуха, что приводит к образованию окиси железа (ружья) или ржавчины. Железо также может образовывать соединения с различными элементами, такими как сера, фосфор и углерод. Это создает основу для получения стали и железных сплавов, которые обладают высокой прочностью и стойкостью к коррозии.
Железо является одним из самых важных элементов в химии благодаря его высокой распространенности, уникальным свойствам и широкому спектру применения в промышленности.
Химические свойства железа и их характеристика

Железо – химический элемент с атомным номером 26 и символом Fe. У него есть несколько характеристических свойств, определяющих его поведение в химических реакциях.
- Активность: Железо является активным металлом и относится к группе д-элементов в периодической системе. Это означает, что оно способно образовывать соединения с различными элементами.
- Коррозия: Железо подвержено коррозии, то есть окислению воздухом и водой. При окислении железо образует ржавчину – смесь гидроксидов и оксидов железа. Для защиты от коррозии железо покрывают слоем оксида или наносят на него защитные покрытия.
- Способность к образованию ионов: Железо может образовывать два основных типа ионов – железо(II) (Fe2+) и железо(III) (Fe3+). Это связано с наличием внешних электронных оболочек, которые могут участвовать в химических реакциях.
- Возможность образования соединений: Железо способно образовывать различные соединения с кислородом, серой, фосфором и другими элементами. Некоторые из этих соединений имеют важное применение в промышленности и медицине.
Химические свойства железа делают его важным элементом во многих отраслях науки и промышленности. Оно используется в производстве стали, синтезе различных соединений, электролитическом осаждении и других процессах. Понимание химических свойств железа позволяет контролировать его поведение и создавать новые материалы и соединения с нужными свойствами.
Физические свойства

Железо - металлический элемент, обладающий рядом характеристических физических свойств.
Первое из этих свойств - магнитные свойства. Железо является магнетиком и обладает высокой магнитной восприимчивостью. Это свойство позволяет использовать железо в производстве постоянных магнитов, в магнитных системах и электромагнитах.
Второе важное свойство - электропроводность. Железо является хорошим проводником электричества и широко применяется в электротехнике, в особенности в производстве электродвигателей и проводов.
Также следует отметить термические свойства железа. Оно обладает высокой теплопроводностью, что делает его полезным материалом для изготовления различных теплопроводящих деталей, например, радиаторов и трубопроводов.
Еще одно свойство, которое можно выделить, это пластичность. Железо легко поддается обработке, чертежной и литьевой, что позволяет изготавливать разнообразные детали и изделия из железа.
Наконец, физическим свойством железа является его относительно высокая плотность. Это означает, что конструкции, выполненные из железа, могут быть прочными и компактными, что очень важно в машиностроении и строительстве.
Химические свойства

Железо обладает различными химическими свойствами, что делает его важным элементом для многих процессов и реакций.
Одним из ключевых химических свойств железа является его способность образовывать соединения с другими элементами. Железо может образовывать химические соединения с кислородом, серой, фосфором и другими элементами. Это позволяет использовать его в различных промышленных процессах, таких как производство стали и сплавов.
Еще одним важным химическим свойством железа является его способность к окислению и восстановлению. Железо может получать и отдавать электроны в реакциях окисления и восстановления, что делает его полезным в различных электрохимических процессах, включая производство электроэнергии в батареях и аккумуляторах.
Еще одним интересным химическим свойством железа является его способность реагировать с кислородом и образовывать оксиды железа. Например, при окислении железа в присутствии влаги образуется ржавчина – темно-коричневое соединение, которое является признаком химической реакции между железом и кислородом.
Одной из специфических химических реакций, в которых может участвовать железо, является его способность образовывать комплексные соединения с различными лигандами, такими как аммиак, цианиды и органические соединения. Эти реакции позволяют использовать железо в качестве катализатора в различных химических процессах.
Взаимодействие железа с кислотами
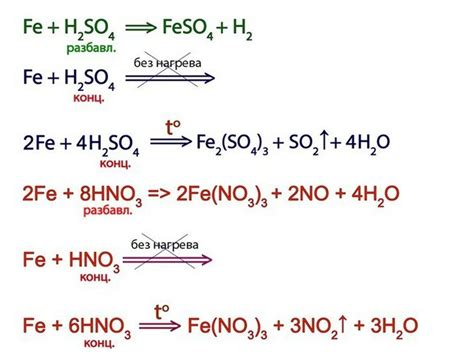
Железо может образовывать различные реакции с кислотами, проявляющиеся в образовании солей и выделении водорода. Реакция железа с кислотами зависит от их концентрации и характера.
Сильные минеральные кислоты, такие как соляная (HCl) и серная (H2SO4), обладают способностью растворять железо, при этом выделяется водородный газ и образуются соответствующие соли. Данная реакция происходит следующим образом:
Fe + 2HCl -> FeCl2 + H2↑
Fe + H2SO4 -> FeSO4 + H2↑
Кроме того, железо может взаимодействовать с некоторыми другими кислотами, например, с азотной (HNO3) и хлорной (HClO).
Реакция железа с азотной кислотой приводит к образованию азота и соответствующей соли:
Fe + 6HNO3 -> Fe(NO3)3 + 3H2O + 2NO↑
Взаимодействие железа с хлорной кислотой также приводит к образованию соли:
2Fe + 3HClO -> 2FeCl3 + 3H2O
Таким образом, взаимодействие железа с кислотами приводит к образованию соответствующих солей и выделению водорода или других продуктов.
Реакция железа с водой

Реакция железа с водой является важным химическим процессом, который происходит при контакте металла с водой. Железо обладает рядом свойств, которые делают его активным в данной реакции.
Когда погружается в воду, железо вступает в химическую реакцию с кислородом и водой, при этом образуется гидроксид железа и выделяется водород. Реакция протекает с выделением тепла.
Гидроксид железа, образующийся в результате реакции, имеет особую структуру и свойства. Он является прочным осадком, который не растворяется в воде. Гидроксид железа используется в различных областях, включая производство красок, стекла и керамики.
Реакция железа с водой имеет практическое применение в железнодорожном и морском транспорте. Железо, находясь в контакте с водой, может подвергаться коррозии - процессу разрушения металла под воздействием окружающей среды. Для защиты железа от коррозии используются специальные покрытия или препараты, которые способствуют образованию защитной пленки.
Применение железа

1. Производство стали: Железо является основным компонентом стали, которая широко применяется в промышленности. Оно используется для изготовления автомобилей, зданий, мостов, оружия и других строительных материалов.
2. Производство электроники: Железо используется для создания магнитных материалов, которые необходимы для производства электронных компонентов, таких как трансформаторы, индукторы и дроссели.
3. Производство лекарств: Железо входит в состав многих лекарственных препаратов, таких как препараты для лечения анемии, гемоглобина и других заболеваний, связанных с дефицитом железа в организме.
4. Архитектурное строительство: Железо используется для создания различных архитектурных конструкций, таких как мосты, каркасы зданий и другие металлические элементы.
5. Производство судов: Железо применяется для изготовления корпусов судов, а также для создания различных металлических деталей, необходимых для их функционирования.
6. Производство автомобилей: Железо используется для создания различных металлических деталей автомобиля, таких как двигатель, рама, тормозные системы и другие.
7. Производство бытовой техники: Железо применяется для изготовления различных бытовых приборов, таких как холодильники, плиты, стиральные машины и другие.
8. Производство оружия: Железо используется для создания различных видов оружия, включая огнестрельное и холодное оружие.
9. Производство украшений: Железо используется в ювелирном искусстве для создания различных видов украшений, таких как кольца, браслеты, серьги и другое.
10. Производство пищевых продуктов: Железо используется в пищевой промышленности в качестве добавки для обогащения продуктов питания железом и улучшения их пищевой ценности.
Окисление железа и его реакции

Окисление железа – это процесс, при котором железо взаимодействует с кислородом и образует оксиды. Окисление железа может происходить как в атмосферных условиях, вызывая коррозию железных поверхностей, так и в химических реакциях. В результате окисления железа возникают разнообразные соединения, которые могут иметь как положительную, так и отрицательную окислительную способность.
Реакции окисления железа – это химические процессы, при которых железо взаимодействует с окислителем и образует соединения различного типа. Одной из наиболее известных реакций окисления железа является реакция его взаимодействия с кислородом воздуха. При этой реакции образуется оксид железа, который может иметь различные степени окисления.
Примеры реакций окисления железа:
- Железо (Fe) + кислород (O2) → оксид железа (FeO)
- Железо (Fe) + вода (H2O) + кислород (O2) → гидроксид железа (Fe(OH)3)
Также реакция окисления железа может происходить с участием различных кислот и других окислителей. Например, при взаимодействии железа с хлорной кислотой образуется хлорид железа, а с серной кислотой – сульфат железа. Эти соединения находят применение в различных отраслях промышленности, например, в производстве стали и металлургии.
Итак, окисление железа – это важный процесс, который является основой для получения различных соединений железа и их применения в разных сферах деятельности.
Окислительно-восстановительные свойства железа

Железо обладает выраженными окислительно-восстановительными свойствами, благодаря которым находит широкое применение в различных процессах.
Окислительные свойства железа проявляются в его способности при взаимодействии с другими веществами передавать электроны и самостоятельно участвовать в реакциях. Железо способно окислять ион Fe(II) до Fe(III), образуя соответствующие соли, например, FeCl3 или Fe2(SO4)3. Это свойство железа используется в процессах окисления воды, хлорида натрия и других веществ.
Вместе с тем, железо проявляет восстановительные свойства, т.е. может само принимать на себя электроны и восстанавливаться от Fe(III) до Fe(II). Это свойство находит применение в различных реакциях, например, в процессе получения железных сплавов или восстановлении окислителей в промышленных и химических процессах.
Вопрос-ответ

Какие свойства имеет железо?
Железо является химическим элементом, у которого множество свойств. Оно обладает серым металлическим блеском, хорошей проводимостью электрического тока и тепла, магнитными свойствами. Железо имеет плотность 7,874 г/см³, температуру плавления 1535 °C и температуру кипения 2750 °C. В окружающей среде оно активно взаимодействует с кислородом, образуя ржавчину.
Как применяется железо?
Железо имеет широкое применение в различных отраслях промышленности и быта. Оно используется в металлургии для производства стали, а также в производстве различных металлических изделий, машин, автомобилей, судов и т.д. Железо также является важным компонентом пищевых добавок и препаратов для лечения анемии.
Какие реакции может совершать железо?
Железо может участвовать во множестве реакций. Например, оно реагирует с кислородом из воздуха, образуя ржавчину. Также железо может реагировать с кислотами, в том числе соляной и серной, образуя соответствующие соли и выделяя водород. Оно также может вступать в реакции с некоторыми неорганическими и органическими соединениями, образуя различные продукты.
