Металлы – это группа химических элементов, которые обладают высокой теплопроводностью, электропроводностью и блеском. Они находятся слева в таблице химических элементов и представляют большинство элементов в периодической системе.
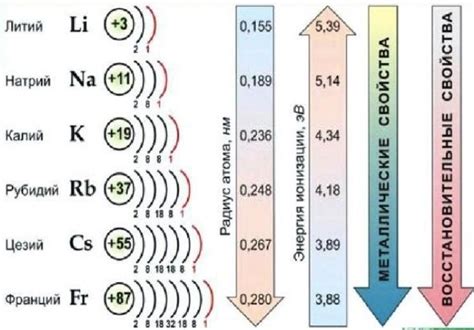
Первая группа металлов включает алкалии, такие как литий, натрий и калий. Они имеют низкую плотность, низкую температуру плавления и реагируют с водой.
Вторая группа металлов, также известная как щелочноземельные металлы, включает бериллий, магний и кальций. Они имеют высокую плотность, высокую температуру плавления и реагируют с кислородом.
Переходные металлы – это элементы в середине таблицы, начиная со скандия и заканчивая цинком. Они обладают различными свойствами и имеют высокую температуру плавления, жесткость и прочность. Многие из них имеют цветные соединения и используются в производстве красок и красителей.
Лантаноиды и актиноиды – это ряды элементов, которые следуют за переходными металлами. Эти металлы имеют сложную структуру и обладают свойствами, сходными с группами переходных металлов. Они являются редкоземельными элементами и используются в различных технологиях, включая производство электроники и магнитов.
Химические свойства и реактивность металлов определяются их положением в таблице химических элементов. Это положение также влияет на их физические свойства, такие как плотность, температура плавления и проводимость.
Основные свойства металлов в таблице химических элементов
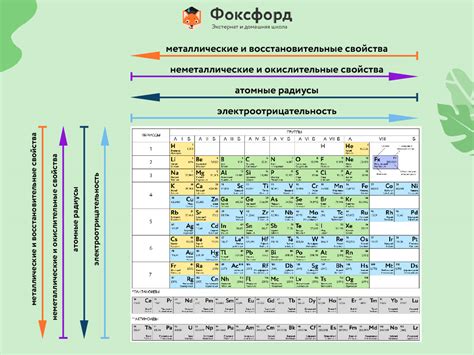
Металлы являются одним из основных классов химических элементов, которые представлены в таблице Менделеева. Они характеризуются рядом уникальных свойств, которые определяют их важное место в различных отраслях науки и промышленности.
1. Проводимость электричества и тепла: Металлы обладают высокой электрической и тепловой проводимостью. Это связано с наличием свободных электронов в их валентной оболочке, которые способны передавать энергию.
2. Пластичность и формовочная способность: Металлы легко поддаются деформации и способны принимать различные формы без разрушения структуры. Благодаря этим свойствам, они широко используются в производстве различных металлических изделий.
3. Относительная твердость и прочность: Многие металлы обладают высокой твердостью и прочностью, что позволяет им выдерживать большие нагрузки и быть стойкими к механическому воздействию.
4. Блеск и отражательная способность: Металлы обладают блеском, который обусловлен отражением света от их поверхности. Это свойство делает их привлекательными для использования в ювелирных украшениях и других декоративных изделиях.
5. Коррозионная стойкость: Некоторые металлы, такие как золото и платина, обладают высокой коррозионной стойкостью. Это позволяет им сохранять свою блеск и свойства длительное время и использоваться в производстве ювелирных изделий и электроники.
6. Различные химические свойства: Металлы могут проявлять различные химические свойства в зависимости от своего положения в таблице химических элементов. Например, щелочные металлы, такие как натрий и калий, обладают большой реакционной способностью, в то время как платина и золото практически не реагируют с другими веществами.
Металлы блочные: характеристика и примеры
Металлы блочные – это элементы, расположенные в таблице химических элементов справа от главной подгруппы боковых блоков, включая группы с III по XII. Они представляют собой разнообразную группу металлов, которые отличаются своими химическими и физическими свойствами.
Одной из главных характеристик металлов блочных является их способность образовывать положительные ионы. Эти металлы обладают высокой электропроводностью и теплопроводностью, что делает их полезными в различных промышленных процессах и технологиях.
Примерами металлов блочных являются алюминий, железо, цинк, медь, серебро и золото. Алюминий обладает низкой плотностью и хорошей коррозионной стойкостью, поэтому его часто используют в строительстве и авиации. Железо является одним из самых распространенных металлов и используется во многих отраслях, включая производство стали. Цинк используется для покрытия других металлов с целью защиты от коррозии, а медь используется в электротехнике и электронике. Серебро и золото ценятся за свою драгоценность и используются в ювелирном деле и производстве электронных компонентов.
Полуметаллы и их свойства

Полуметаллы – это группа химических элементов, которые обладают свойствами как металлов, так и неметаллов. Они занимают промежуточное положение между металлами и неметаллами в таблице химических элементов.
Одним из самых известных полуметаллов является кремний. Он обладает металлическим блеском и относительно высокой электропроводностью, но при этом имеет неметаллическую химическую активность. Кремний широко используется в электронной промышленности, в производстве полупроводниковых приборов.
Другим примером полуметалла является графит. Он обладает металлическим блеском, но является плохим теплопроводником. Графит также отличается свойствами неметалла, такими как низкая электропроводность и химическая инертность. Из-за своей структуры графит обладает изумительными свойствами смазки, и широко применяется в производстве чернил для письма и лубрикантов.
Еще одним наиболее известным полуметаллом является лютеций. Он обладает металлическими свойствами, но при этом отличается низкой электропроводностью и химической активностью. Лютеций применяется в электронике, в производстве электродов для сварки и в других отраслях промышленности.
Таким образом, полуметаллы представляют собой уникальную группу элементов, обладающих свойствами и металлов, и неметаллов. Их свойства и применение в различных отраслях промышленности делают их важными и ценными элементами в современном мире.
Постпереходные металлы: особенности и использование
В таблице химических элементов постпереходные металлы находятся между переходными металлами и мета
Валентность металлов: значение и влияние на свойства
Валентность металлов – это число электронов, которые может отдать атом металла или принять от других атомов во время химических реакций. Она определяет, сколько связей может образовать атом металла и какие ионы он может образовывать.
Значение валентности металла влияет на его свойства, такие как способность образовывать соединения, реакционную активность, проводимость электричества и тепла. Металлы с низкой валентностью имеют тенденцию образовывать ионы с положительным зарядом, а металлы с высокой валентностью могут образовывать ионы с разными зарядами.
Например, кадмий имеет валентность +2, поэтому образует ионы Cd²⁺. Эти ионы проявляют стабильность, что делает кадмий пригодным для использования в аккумуляторах. С другой стороны, хром имеет валентность +3 и +6 и может образовывать ионы Cr³⁺ и Cr⁶⁺. Эта разнообразная валентность позволяет хрому проявлять различные химические свойства, такие как окислительная или восстановительная активность.
Валентность металлов также определяет, насколько электроны внешней электронной оболочки атома металла связаны с ядром. Чем выше валентность, тем слабее связаны эти электроны, что облегчает их участие в химических реакциях. Например, железо имеет валентность +2 и +3. Это обеспечивает гибкость соединений железа и их способность быстро вступать во взаимодействие с другими веществами.
Валентность металлов имеет значительное влияние на их химические и физические свойства. Она определяет возможность образования соединений, реакционную активность и способность проводить электричество, что делает ее важным параметром для понимания металлургии и применения металлов в различных отраслях промышленности.
Свойства щелочных металлов и их значение в химии
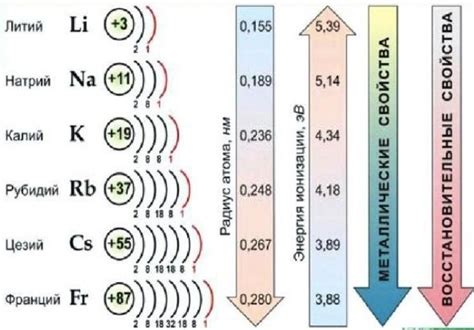
Щелочные металлы – это элементы, расположенные в первой группе периодической таблицы химических элементов. К ним относятся литий, натрий, калий, рубидий, цезий и франций. У щелочных металлов есть несколько общих свойств, которые играют важную роль в химии.
Первое свойство – низкая электроотрицательность. Щелочные металлы являются самыми активными металлами, так как они имеют низкую способность притягивать электроны. Это позволяет им образовывать ионные связи с другими элементами, образуя соли.
Второе свойство – высокая реактивность. Щелочные металлы легко вступают в реакции с водой и кислородом, что часто приводит к взрывоопасным реакциям. Их реактивность сочетается с низкой плотностью, что делает их легкими металлами.
Третье свойство – высокая проводимость электричества и тепла. Щелочные металлы хорошие проводники электричества и тепла, что делает их полезными для различных технических и промышленных приложений.
Четвертое свойство – образование оксидов. Щелочные металлы легко окисляются воздухом, образуя оксиды. Эти оксиды имеют щелочную природу и могут использоваться, например, для нейтрализации кислот.
Знание свойств щелочных металлов позволяет ученым и инженерам использовать их в различных областях химии и технологии. Они могут применяться в производстве батарей, металлургии, фармацевтике и других сферах, благодаря своим уникальным свойствам.
Редкоземельные металлы: уникальные свойства и применение

Редкоземельные металлы – группа химических элементов, находящихся в периодической системе химических элементов в серии лантаноидов (57-71). Эти металлы обладают рядом уникальных физических и химических свойств, которые делают их неотъемлемой частью различных технологий и процессов.
Одной из особенностей редкоземельных металлов является их высокая реакционность, что позволяет им образовывать разнообразные соединения с другими элементами. Это свойство находит широкое применение в производстве катализаторов, магнитов, фоточувствительных материалов и других технологий.
Еще одно уникальное свойство редкоземельных металлов – их способность образовывать стабильные сплавы с другими металлами. Это позволяет использовать их в производстве многочисленных легких и прочных сплавов, которые находят применение в авиационной и ракетно-космической промышленности, а также в производстве мобильных телефонов и компьютерной техники.
Кроме того, редкоземельные металлы обладают высокой магнитной и термической стабильностью, что делает их незаменимыми в производстве постоянных магнитов и теплостойких материалов. Они также находят применение в лазерах, светофильтрах, оптических волокнах и других высокотехнологичных устройствах.
Выводя за пределы пользоватеся, редкоземельные металлы являются важным компонентом современной высокотехнологичной промышленности и науки. Без них было бы невозможно создание множества современных устройств и технологий, на которых основана современная цивилизация.
Вопрос-ответ

Какая основная характеристика металлов на основании их положения в таблице химических элементов?
Основная характеристика металлов на основании их положения в таблице химических элементов - это то, что большинство металлов расположены слева от черты-разделителя в таблице их элементов (типа 2), а также в лантаноидных и актиноидных рядах. Металлы обладают характеристиками, такими как хорошая электропроводность, теплопроводность, гибкость и металлический блеск.
Какие свойства обладают металлы на основании их положения в таблице химических элементов?
Металлы на основании их положения в таблице химических элементов обладают рядом свойств, таких как высокая электропроводность, теплопроводность и металлический блеск. Они способны проводить электрический ток благодаря наличию свободных электронов в их электронных оболочках. Также многие металлы обладают высокой пластичностью, что позволяет им быть формованными и прочными.
Какие элементы в периодической таблице являются металлами?
Большинство элементов в периодической таблице являются металлами. Все элементы от лития (Li) до бериллия (Be) и от натрия (Na) до алюминия (Al) являются металлами. Кроме того, большинство элементов после алюминия и до порядка атомного номера 80, включая калий (K), кальций (Ca) и железо (Fe), также являются металлами. Некоторые элементы из блоков d и f также являются металлами, как, например, железо (Fe), медь (Cu) и свинец (Pb).
Какое значение имеет положение металлов в таблице химических элементов?
Положение металлов в таблице химических элементов имеет большое значение, так как оно помогает определить их основные химические и физические свойства. Основная их характеристика - это то, что большинство металлов расположены слева от черты-разделителя в таблице их элементов (типа 2), а также в лантаноидных и актиноидных рядах. Это позволяет им обладать характеристиками, такими как хорошая электропроводность, теплопроводность, гибкость и металлический блеск. Положение металлов также помогает определить их реактивность и способность образовывать ионы положительного заряда.
