Оксиды щелочных металлов - это соединения, получаемые путем реакции металлов с кислородом. Щелочные металлы включают такие элементы, как литий, натрий, калий и другие. Оксиды щелочных металлов обладают рядом характеристических свойств, которые делают их широко распространенными в различных областях науки и техники.
Свойства оксидов щелочных металлов включают высокую температуру плавления и кипения, а также способность проводить электрический ток. Они обладают также щелочными свойствами, что означает их способность растворяться в воде и образовывать гидроксиды. Оксиды щелочных металлов обычно являются бесцветными кристаллами и имеют сильную щелочность.
Применение оксидов щелочных металлов разнообразно и находится на пересечении различных областей. В химической промышленности они используются в процессах синтеза органических соединений, в производстве стекла и керамики, а также в производстве щелочей. В электротехнике оксиды щелочных металлов применяются в качестве электролитов и методов хранения ионов. Оксиды щелочных металлов также находят применение в металлургии, катализе и других отраслях промышленности.
Синонимы и определение

Оксиды щелочных металлов - это химические соединения, состоящие из щелочного металла и кислорода. Они обладают типичными свойствами оксидов и характерными особенностями, связанными с присутствием ионов щелочного металла в структуре.
Синонимы для оксидов щелочных металлов могут включать в себя следующие термины: щелочные оксиды, оксиды щелочных элементов, оксиды щелочных металлов и т.д. Они отражают различные аспекты или точки зрения на эти химические соединения.
Оксиды щелочных металлов широко применяются в различных областях. Они используются в производстве стекла, электролитических растворов, щелочных батарей, катализаторов и других химических реагентов. Их свойства, такие как щелочная реакция в воде, высокие температуры плавления и электропроводность, делают их уникальными веществами и полезными в различных технологических процессах.
Оксиды щелочных металлов имеют важное значение в химии и научных исследованиях. Их структура и свойства исследуются для разработки новых сплавов, материалов и каталитических систем. Эти соединения также играют роль в различных биологических процессах и имеют медицинское применение в виде лекарств и добавок к пище.
Химический состав и структура

Оксиды щелочных металлов представляют собой химические соединения, состоящие из атомов щелочных металлов и кислорода. Примерами таких оксидов являются оксид натрия (Na2O), оксид калия (K2O) и оксид лития (Li2O). Химическая формула указывает на то, что в молекуле оксида присутствует два атома металла и один атом кислорода.
Оксиды щелочных металлов имеют ионную структуру, где атомы щелочных металлов образуют положительно заряженные ионы, а кислород - отрицательно заряженные ионы. Эти ионы сцеплены электростатическими силами притяжения. Оксиды щелочных металлов обычно обладают кристаллической структурой, при которой ионы металла и кислорода образуют регулярные узоры.
Структура оксидов щелочных металлов влияет на их свойства. Например, кристаллическая структура делает эти соединения твердыми веществами с определенными точками плавления и кипения. Также структура оксидов определяет их растворимость в воде. Некоторые оксиды щелочных металлов, такие как оксид натрия и оксид калия, легко растворяются в воде, образуя растворы с щелочной реакцией.
Оксиды щелочных металлов обладают разнообразными применениями в промышленности и научных исследованиях. Например, оксид натрия используется в стекольной промышленности для производства стекла, оксид калия применяется в производстве щелочных удобрений, а оксид лития находит применение в аккумуляторах и синтезе различных органических соединений.
Физические и химические свойства
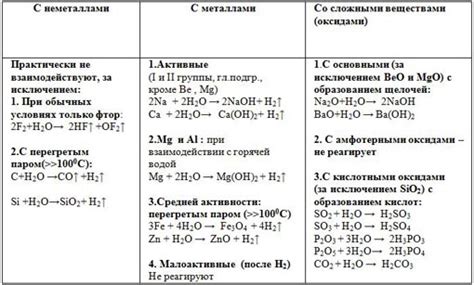
Физические свойства оксидов щелочных металлов: оксиды щелочных металлов обычно представляют собой твердые вещества, которые в большинстве случаев обладают высокой температурой плавления и кипения. Кроме того, они имеют низкую плотность и часто обладают хорошей проводимостью электричества.
Химические свойства оксидов щелочных металлов: оксиды щелочных металлов обладают базическими свойствами, то есть растворяются в воде с образованием щелочных растворов. Они также реактивны и могут взаимодействовать с кислородом, кислотами и другими химическими веществами, образуя соли щелочных металлов.
Один из примеров использования оксидов щелочных металлов - производство стекла. Оксиды щелочных металлов (например, оксид натрия) используются в качестве сырья для получения стекла. Они способны придавать стеклу определенные свойства, такие как прозрачность, твердость и химическую стойкость.
Еще одним примером использования оксидов щелочных металлов является производство щелочных батарей. Оксид калия, присутствующий в таких типах батарей, является одним из ключевых компонентов, обеспечивающих энергетическую реакцию внутри батареи.
Оксиды щелочных металлов также используются в различных химических процессах, например, в производстве мыла, моющих средств и дезинфицирующих средств. Кроме того, они могут быть использованы в качестве катализаторов, которые ускоряют химические реакции.
Применение в промышленности

Оксиды щелочных металлов имеют широкое применение в различных отраслях промышленности благодаря своим уникальным свойствам.
В первую очередь оксиды щелочных металлов используются как активные катализаторы в химической промышленности. Они способны ускорять химические реакции и обеспечивать повышение эффективности процессов, таких как синтез органических соединений или очистка отработанных газов.
Другим важным применением оксидов щелочных металлов является их использование в стекольной промышленности. Они обладают свойствами, которые позволяют снизить температуру плавления стекла, улучшить его прозрачность и устойчивость к механическим воздействиям. Кроме того, оксиды щелочных металлов добавляются в состав эмалей и глазури, придают им особые светоотражающие или защитные свойства.
Оксиды щелочных металлов также используются в производстве прозрачных электролитов для тополитиевых аккумуляторов. Эти материалы обладают высокой электропроводностью и хорошей стабильностью при циклической зарядке и разрядке, что делает их идеальным выбором для использования в портативной электронике и электромобилях.
Некоторые оксиды щелочных металлов, например оксид натрия, нашли свое применение в производстве бумаги. Они используются в качестве регуляторов pH растворов, обеспечивая стабильность и контроль над процессом обработки целлюлозы.
Таким образом, использование оксидов щелочных металлов в промышленности играет важную роль, обеспечивая улучшение производственных процессов, снижение затрат и повышение качества конечной продукции.
Применение в медицине и лаборатории
Оксиды щелочных металлов, такие как оксид натрия (Na2O) и оксид калия (K2O), имеют широкое применение в медицине и лаборатории.
- В медицине: Оксиды щелочных металлов используются в процессе производства лекарственных препаратов. Они могут быть использованы в качестве компонентов для создания стабильной формы лекарственных веществ, а также для регулирования кислотно-щелочного баланса в организме человека.
- В лаборатории: Оксиды щелочных металлов широко применяются в лабораториях для проведения различных химических исследований и анализов. Например, оксид натрия может быть использован в качестве индикатора для качественного определения кислотности или щелочности растворов.
Другим важным применением оксидов щелочных металлов в медицине и лаборатории является их использование в процессе производства стекла и керамики. Оксиды щелочных металлов играют роль стеклонаплавляющих агентов, которые снижают температуру плавления стеклянной массы и улучшают ее текучесть. Благодаря этому, оксиды щелочных металлов используются для создания различных медицинских и лабораторных стеклянных изделий, таких как пробирки, чаши, стаканы и другие емкости.
Таким образом, оксиды щелочных металлов являются важной составляющей медицины и лабораторной практики, благодаря своим уникальным свойствам и возможностям использования.
Влияние на окружающую среду

Оксиды щелочных металлов являются химическими соединениями, которые оказывают значительное влияние на окружающую среду. Эти соединения обладают рядом свойств, которые могут привести к негативным последствиям для окружающей среды.
Одним из основных свойств оксидов щелочных металлов является их алкальность. Они образуют гидроксиды при контакте с водой, что может вызывать изменение pH водных растворов. Это может негативно сказаться на экосистемах, так как изменение pH может повлиять на жизнь рыб, водных растений и других организмов.
Оксиды щелочных металлов также могут взаимодействовать с атмосферным воздухом. Некоторые из них могут образовывать кислотные дожди, что может вызывать загрязнение почвы и водоемов. Кроме того, эти соединения могут участвовать в образовании смога и других загрязнений атмосферы.
Применение оксидов щелочных металлов в промышленности также может приводить к негативному влиянию на окружающую среду. Их использование в процессах производства может сопровождаться выбросами вредных веществ, которые загрязняют атмосферу и водные ресурсы. Поэтому необходимо осуществлять контроль и предпринимать меры по снижению выбросов вредных веществ.
В целом, оксиды щелочных металлов оказывают негативное влияние на окружающую среду и требуют внимания со стороны научного сообщества, промышленных предприятий и государственных органов. Разработка и внедрение экологически безопасных технологий и мер по сокращению выбросов являются важными направлениями в области охраны окружающей среды и устойчивого развития.
Вопрос-ответ

Какие свойства имеют оксиды щелочных металлов?
Оксиды щелочных металлов обладают следующими свойствами: высокая степень растворимости в воде, образование щелочей при реакции с водой, щелочные оксиды распадаются на ионы водорода и оксиды металлов, образование щелочей при реакции с кислотами.
Какие применения есть у оксидов щелочных металлов?
Оксиды щелочных металлов находят широкое применение в различных сферах. Например, оксид натрия (Na2O) используется в производстве стекла и мыла, оксид калия (K2O) применяется для производства удобрений и стекла. Оксиды щелочных металлов также используются в процессе получения щелочной растворимой соли, известной как пестицид, и в качестве катализаторов в различных химических реакциях.
