Щелочные металлы представляют собой группу элементов, расположенных в первой группе периодической системы. В периодической системе они находятся слева от периодов и имеют общую химическую характеристику - высокую щелочность. В эту группу входят элементы литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они являются очень активными металлами, реагируя с водой, кислородом и другими химическими элементами.
Первый и самый легкий элемент этой группы - литий (Li). Он обладает наименьшей электроотрицательностью из всех элементов периодической таблицы, что делает его самым активным щелочным металлом. Литий является легким и мягким металлом и может быть использован в различных промышленных и научных областях.
Другие щелочные металлы - натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr) имеют похожие свойства. Они также активно реагируют с водой, выделяясь водородом, и хорошо растворяются в водах, образуя щелочные растворы. Кроме того, они обладают малой плотностью, что делает их легкими металлами, и являются отличными проводниками тепла и электричества.
Щелочные металлы имеют широкое применение в различных отраслях промышленности и науки. Их соли используются в пищевой промышленности, медицине, стекловарении и производстве щелочных элементов и аккумуляторов. Кроме того, они могут быть использованы в процессах обогащения руды и выделении драгоценных металлов.
Всещелочные металлы обладают высокой реактивностью и являются неотъемлемой частью науки и технологии. Их химические и физические свойства делают их полезными для широкого спектра применений, что достигается за счёт их отличной активности и уникальных характеристик.
Положение щелочных металлов в периодической системе

Щелочные металлы представляют собой группу элементов, расположенных в первой группе периодической системы. Они включают в себя литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr).
Щелочные металлы характеризуются своей низкой электроотрицательностью и высокой активностью. В результате этого они обладают способностью легко отдавать свой внешний электрон, что делает их металлическими элементами, обладающими сильнощелочными свойствами.
Положение щелочных металлов в периодической системе определяет их электронную конфигурацию. Они имеют один электрон в своем внешнем энергетическом уровне (s-орбитали), что придает им их основные химические свойства и реакционную способность.
- Литий (Li) и натрий (Na) образуют оксиды, гидроксиды, карбонаты и другие соединения, которые характеризуются высокой щелочностью.
- Калий (K), рубидий (Rb) и цезий (Cs) также образуют щелочные соединения, но их свойства становятся более выраженными из-за их более низкой электроотрицательности и больших размеров атомов.
- Франций (Fr) является самым редким и реактивным щелочным металлом. Из-за его короткого периода полураспада и высокой радиоактивности, он очень редко встречается в природе и имеет ограниченные промышленные применения.
Положение щелочных металлов в периодической системе определяет их связь с другими элементами и группами. Они образуют ряд алкалиевых соединений и сплавов, которые широко применяются в различных областях, включая производство стекла, лужения металлов и производство батарей.
Для наглядности можно использовать таблицу:
| Элемент | Атомный номер | Относительная атомная масса |
|---|---|---|
| Литий (Li) | 3 | 6,94 |
| Натрий (Na) | 11 | 22,99 |
| Калий (K) | 19 | 39,10 |
| Рубидий (Rb) | 37 | 85,47 |
| Цезий (Cs) | 55 | 132,91 |
| Франций (Fr) | 87 | 223 |
Химические свойства щелочных металлов

Щелочные металлы – это элементы, которые расположены в первой группе периодической системы. Они включают литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr).
Четыре из шести щелочных металлов – литий, натрий, калий и рубидий – реагируют с водой, давая щелочные растворы и выделяя водород. Цезий и франций также реагируют с водой, но при этом возникает воспламенение. Это свидетельствует об их высокой реакционной активности.
Характерной особенностью щелочных металлов является то, что они образуют катионы с единичным положительным зарядом. Это связано с тем, что они имеют один валентный электрон во внешней электронной оболочке. В своих реакциях они стремятся отдать этот электрон, чтобы достичь электронной конфигурации инертного газа.
Щелочные металлы реагируют с неметаллами, образуя соли. Например, при реакции с кислородом они образуют оксиды, а с хлором – хлориды. Реакция настолько интенсивна, что при контакте с воздухом поглощают кислород, образуя оксиды. Именно поэтому щелочные металлы хранятся под слоем минерального масла или в инертной среде.
Оксиды щелочных металлов обладают щелочными свойствами и реагируют с водой, образуя щелочные растворы. Это связано с высокой основностью оксидов щелочных металлов. Например, при реакции оксида натрия (Na2O) с водой образуется натриевая щелочь (NaOH). Щелочные растворы щелочных металлов обладают высокой щелочностью и обычно имеют высокий pH.
Физические свойства щелочных металлов

1. Относительно низкая плотность: Щелочные металлы, такие как литий, натрий и калий, обладают относительно низкой плотностью. Она уменьшается от лития к цезию вверх по группе. Например, плотность лития составляет около 0,53 г/см³, а плотность цезия - около 1,93 г/см³.
2. Низкая температура плавления: Щелочные металлы обладают низкой температурой плавления. Например, натрий плавится при температуре около 98 градусов Цельсия, калий - при 64 градусах Цельсия, и рубидий - при 39 градусах Цельсия.
3. Мягкость и пластичность: Щелочные металлы обладают высокой мягкостью и пластичностью. Они легко поддаются обработке и могут быть раскатаны в тонкие ленты или прокатаны в проволоку.
4. Способность к окислению: Щелочные металлы имеют высокую способность к окислению, особенно в присутствии влаги или кислорода. Например, калий и натрий реактивно реагируют с водой, образуя щелочные гидроксиды и выделяя водород.
5. Низкая температура плавления: Щелочные металлы обладают высокой электропроводностью. Они являются хорошими проводниками электричества и могут быть использованы в различных электрических устройствах.
Общие характеристики щелочных металлов

Щелочные металлы - это элементы, относящиеся к первой группе периодической системы. К ним относятся литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). У щелочных металлов имеются несколько общих характеристик, которые делают их уникальными и отличают от других элементов.
1. Металлические свойства:
Щелочные металлы обладают высокой проводимостью тепла и электричества, что делает их хорошими проводниками. Они обладают металлическим блеском и мягкостью. Однако, хотя они являются металлами, они имеют очень низкую плотность и низкую температуру плавления.
2. Активность:
Щелочные металлы являются самыми активными металлами. Они легко реагируют с кислородом, водой и другими химическими веществами. Они образуют щелочные оксиды, гидроксиды и соли. Реакция с водой в одной из наиболее известных характеристик щелочных металлов, приводящая к образованию щелочей.
3. Низкая плотность:
Щелочные металлы имеют низкую плотность из-за их атомной структуры и кристаллической упаковки. Наиболее низкую плотность имеет литий, а наиболее высокую - цезий. Из-за своей низкой плотности, щелочные металлы могут плавать на поверхности воды.
4. Высокая реактивность:
Реактивность щелочных металлов обусловлена их электрохимическими свойствами. Они легко отдают внешний электрон и образуют положительные ионы. Их реактивность может привести к взрывам или пожарам, поэтому необходимы специальные меры предосторожности при работе с щелочными металлами.
5. Свойства оксидов:
Щелочные металлы образуют щелочные оксиды, которые растворяются в воде, образуя щелочи. Они также растворяются в кислотах, образуя соли. Оксиды щелочных металлов обладают также высокой основностью и используются в производстве широкого спектра химических продуктов.
Влияние щелочных металлов на окружающую среду

Щелочные металлы, такие как литий, натрий, калий, рубидий и цезий, играют важную роль в различных процессах окружающей среды и оказывают влияние как на естественные, так и на антропогенные системы.
Первое, что следует отметить, это активная реакционная способность щелочных металлов, которая приводит к образованию соединений с другими веществами. Например, взаимодействие натрия с водой приводит к образованию щелочной среды и выделению водорода. Это влияет как на физико-химические свойства воды, так и на биологические процессы, включая жизнедеятельность растений и животных.
Однако, несмотря на их важность, щелочные металлы могут оказывать негативное воздействие на окружающую среду. Например, использование калийных удобрений в сельском хозяйстве может привести к накоплению излишков калия в почвах и загрязнению водных ресурсов. Это может вызывать перекисное окисление воды, что дестабилизирует экосистемы водных бассейнов и может угрожать жизни водных организмов.
Еще одним примером негативного влияния щелочных металлов на окружающую среду является использование лития в производстве литиевых аккумуляторов. При утилизации их отработанных элементов основные компоненты аккумуляторов, включая литий, могут попадать в почву и водные системы, вызывая загрязнение и угрозу здоровью человека и животных.
Таким образом, понимание влияния щелочных металлов на окружающую среду является важным для разработки устойчивых методов производства и использования данных веществ, а также для контроля и предотвращения негативных последствий их воздействия на окружающую среду.
Химические реакции и соединения щелочных металлов

Щелочные металлы – это элементы первой группы периодической системы, включающие литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они характеризуются высокой активностью, образуя разнообразные соединения и проходя химические реакции с многими веществами.
Основной реакцией щелочных металлов является их реакция с водой. При этом образуется соединение щелочного металла с гидроксидом, например, литий реагирует с водой, образуя гидроксид лития:
2Li + 2H2O → 2LiOH + H2
Щелочные металлы также проявляют реактивность при контакте с кислородом воздуха. Они окисляются под действием кислорода и образуют оксиды металлов, например, натрий окисляется до образования оксида натрия:
4Na + O2 → 2Na2O
Щелочные металлы могут образовывать также растворимые соли. Натрий, калий и литий хорошо растворяются в воде, образуя ионы металла и соответствующие анионы, например, натрий образует соль хлорида натрия:
Na + Cl- → NaCl
В реакциях с другими элементами щелочные металлы обладают высокой активностью, часто образуя соли и ионы металла. Например, взаимодействие натрия с хлором приводит к образованию соли – хлорида натрия:
2Na + Cl2 → 2NaCl
Таким образом, щелочные металлы проявляют высокую реакционную способность, образуя разнообразные соединения с другими веществами. Их химические реакции и соединения имеют важное значение в различных областях науки и техники.
Применение щелочных металлов в промышленности и науке
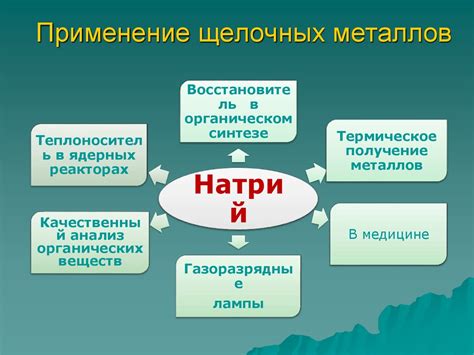
Щелочные металлы, такие как литий, натрий, калий, рубидий и цезий, имеют широкое применение в промышленности и науке благодаря своим уникальным химическим свойствам.
Батареи и аккумуляторы: Литий, который является наименее плотным металлом, часто используется в литий-ионных аккумуляторах, которые являются самыми распространенными типами аккумуляторов на сегодняшний день. Они широко применяются в мобильных телефонах, ноутбуках, электронных устройствах и электромобилях.
Металлургия: Натрий, калий и литий используются в процессах металлургии. Натрий применяется для получения алюминия, а также в производстве стекла и помола цемента. Калий используется для производства удобрений, стекла и мыла. Литий используется в производстве литиевых сплавов и при создании высокопрочных материалов.
Ядерная энергетика: Калий и рубидий используются в ядерной энергетике. Рубидий является хорошим источником ядерного топлива, а калий используется в процессе охлаждения и регулирования температуры ядерных реакторов.
Фармацевтическая промышленность: Щелочные металлы также находят применение в производстве фармацевтических препаратов. Например, натрий и калий являются важными компонентами многих лекарственных средств.
Научные исследования: Цезий широко используется в научных исследованиях, особенно в области атомной физики и квантовой оптики. Он является одним из наиболее чувствительных элементов для измерения времени и используется в атомных часах и точных частотомерах.
Щелочные металлы имеют множество других применений в различных отраслях промышленности и науке, и их уникальные свойства делают их ценными и востребованными материалами.
Особенности взаимодействия щелочных металлов с другими элементами

Щелочные металлы - это элементы первой группы периодической системы, каждый из которых обладает своими химическими свойствами и реактивностью. Одной из особенностей взаимодействия щелочных металлов с другими элементами является их высокая реактивность и легкость образования ионов положительного заряда.
Щелочные металлы легко реагируют с водой, образуя гидроксиды (щелочи) и выделяя водород. Например, литий разрушает воду, артикулируя свою чрезвычайную реактивность. Потому что они имеют низкую ионизацию энергии, щелочные металлы легко отдавать свои электроны другим элементам, особенно неметаллам, таким как кислород.
Взаимодействие щелочных металлов с кислородом приводит к образованию щелочных оксидов, которые могут быть растворимыми или нерастворимыми в воде. Некоторые щелочные металлы также способны образовывать супероксиды, которые более реакционны и обладают большим количеством кислорода.
Особенностью щелочных металлов является их способность образовывать соли со многими другими элементами. Они легко реагируют с галогенами, образуя ионные соединения, такие как хлориды и бромиды. Щелочные металлы также могут реагировать с другими металлами, образуя сплавы и соединения с различными свойствами.
В целом, взаимодействие щелочных металлов с другими элементами характеризуется их высокой реактивностью и способностью образовывать разнообразные соединения, что делает их важными исходными материалами для многих химических реакций и промышленных процессов.
Вопрос-ответ

Какие металлы относятся к щелочным металлам?
К щелочным металлам относятся литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr).
Каково общее свойство щелочных металлов?
Общим свойством щелочных металлов является их большая реактивность, особенно при контакте с водой или кислородом.
Что делает щелочные металлы на самом деле щелочными?
Щелочными металлы делают их химические свойства, которые включают высокую ионизационную энергию и низкую электроотрицательность.
Каково положение щелочных металлов в периодической системе?
Щелочные металлы расположены в первой группе периодической системы, сразу после газообразных элементов группы 18, или инертных газов.
Какая электроотрицательность у щелочных металлов?
Электроотрицательность щелочных металлов обычно низкая и увеличивается от лития до франция. Наименьшая электроотрицательность у франция (0.7), а наибольшая у лития (0.98).
