Щелочноземельные металлы – это группа химических элементов, которая состоит из шести металлов: бериллия (Be), магния (Mg), кальция (Ca), стронция (Sr), бария (Ba) и радия (Ra). Они представляют собой химически активные металлы с высокой степенью реактивности.
В химическом составе щелочноземельные металлы обладают общей чертой – наличием двух валентностей: +2 и +1. Это свойство является результатом полной заполненности внешней электронной оболочки. Две электронные оболочки этих элементов заполнены электронами, и они имеют основную электронную конфигурацию [X] ns2. Поэтому эти металлы способны образовывать соединения, в которых взаимодействуют свободные s-электроны.
Одно из основных свойств щелочноземельных металлов – активность. Они реагируют с водой, кислородом и многими кислотами. Реакция щелочноземельных металлов с водой протекает с образованием гидроксидов и выделением водорода. Этот процесс является очень активным и может быть взрывоопасным, особенно для элементов бария и радия.
Щелочноземельные металлы также проявляют способность к каталитическому воздействию на различные химические реакции и реакции окисления. Они широко используются в промышленности, в производстве легких сплавов, в металлургии и в процессе очистки металлов.
Свойства щелочноземельных металлов определяются их химической природой и способностью образовывать стабильные соединения. Элементы этой группы обладают большими атомными радиусами, что обуславливает их мягкость и пластичность. Они обладают высокой тепло- и электропроводностью, а также малым потенциалом ионизации.
Щелочноземельные металлы
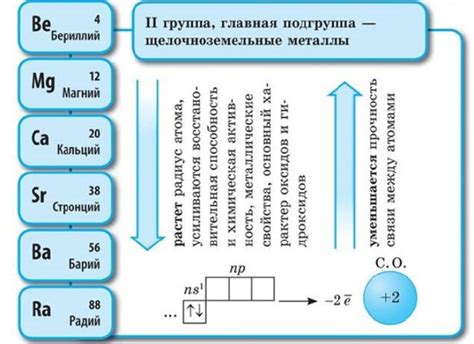
Щелочноземельные металлы - это элементы, расположенные во второй группе периодической системы Менделеева. В эту группу входят бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra).
Химический состав этих металлов характеризуется наличием двух электронов в внешней энергетической оболочке. Из-за этого они обладают высокой активностью и образуют двухвалентные ионы. Они также обладают низкой электроотрицательностью и формируют оксиды и гидроксиды.
Свойства щелочноземельных металлов включают низкую плотность, низкую температуру плавления и кипения, а также высокую проводимость электричества и тепла. Они имеют серебристо-белый цвет и мягкий металлический блеск.
Щелочноземельные металлы обладают высокой реактивностью и реагируют с кислородом, халогенами и водой. Они могут образовывать соли, оксиды и гидроксиды, которые имеют широкое применение в различных областях, включая промышленность, сельское хозяйство и медицину.
- Бериллий используется в производстве легких и прочных сплавов, электронной технике и ядерной энергетике.
- Магний применяется в авиационной и автомобильной промышленности, производстве сплавов, фармацевтической и пищевой промышленности.
- Кальций используется в строительстве, производстве стекла и цемента, а также в медицине.
- Стронций применяется в производстве огнетушителей, ядерной энергетике и в фотографии.
- Барий используется в производстве стекла, красителей, радиологии и нефтедобыче.
- Радий имеет ограниченное применение из-за своей радиоактивности, но используется в научных исследованиях и в медицине.
В целом, щелочноземельные металлы являются важными элементами с широким спектром применения в различных отраслях промышленности и науке.
Химический состав
Щелочноземельные металлы включают в себя следующие элементы: бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra). Они относятся к группе 2 периодической системы элементов и имеют общую характеристику - два электрона в валентной оболочке.
Бериллий - легкий щелочноземельный металл, имеющий атомный номер 4. Он обладает высокой температурой плавления, большой твердостью и отличными механическими свойствами. Бериллий очень хрупок и является химически инертным, но его соединения могут быть ядовитыми.
Магний - наиболее распространенный металл в группе щелочноземельных металлов. Он имеет атомный номер 12 и обладает серебристым цветом. Магний является легким и прочным металлом, обладает хорошей электропроводностью и теплопроводностью. Он является важным компонентом во многих промышленных и бытовых приложениях.
Кальций - элемент с атомным номером 20, является легким металлом желтого цвета. Кальций активно взаимодействует с водой и кислородом, образуя соединения, такие как оксид кальция или гидроксид кальция. Кальций широко используется в производстве легких сплавов, строительных материалов и для регулирования уровня кальция в организмах животных и растений.
Стронций - металл серебристо-белого цвета с атомным номером 38. Он имеет мягкую текстуру и низкую плотность. Стронций легко реагирует с водой и кислородом, образуя соединения, такие как оксид стронция или гидроксид стронция. Стронций используется в различных областях, включая производство огнетушителей, обработку стекла и производство ядерных реакторов.
Барий - тяжелый металл светло-серого цвета с атомным номером 56. Он обладает высокой плотностью и хорошей пластичностью. Барий реагирует с водой и кислородом, образуя соединения, такие как оксид бария или гидроксид бария. Барий используется в различных отраслях, включая производство светофильтров для рентгеновских лучей, в производстве красок и стекла.
Радий - редкий ирадиоактивный металл, атомный номер которого равен 88. Он является самым тяжелым из щелочноземельных металлов. Радий является очень опасным веществом, так как является источником радиации. Его применение ограничено из-за его высокой токсичности и радиоактивности.
Свойства
Щелочноземельные металлы - это группа химических элементов, расположенных во второй группе периодической системы Менделеева. К этой группе относятся бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra). У этих металлов есть ряд общих свойств, которые делают их уникальными и важными во многих сферах.
Ключевым характеристикой щелочноземельных металлов является их отношение к воде. Они реагируют с водой и образуют щелочные растворы. Например, кальций разлагается водой, выделяя газ и образуя щелочь. Это свойство применяется в процессе гашения пожаров, так как металлы могут быстро погасить огонь.
Одним из характерных свойств щелочноземельных металлов является их низкая электроотрицательность. Это означает, что они имеют тенденцию образовывать ионные соединения, в которых металлы отдают свои электроны другим элементам.
Щелочноземельные металлы обладают высокой теплопроводностью и электропроводностью. Это делает их полезными для различных технических применений, таких как производство металлических сплавов и электроники. Бериллий, например, является очень легким и прочным металлом, который используется в авиационной и космической промышленности.
Физические свойства

1. Плотность: Щелочноземельные металлы обладают относительно низкой плотностью. Наибольшей плотностью обладает барий, а наименьшей - бериллий.
2. Температура плавления: Химические элементы из группы щелочноземельных металлов имеют различную температуру плавления. Наименьшую температуру плавления имеет бериллий (1287 °C), а наибольшую - барий (727 °C).
3. Температура кипения: У щелочноземельных металлов температура кипения также различается. Наименьшую температуру кипения имеет магний (1090 °C), а наибольшую - барий (1640 °C).
4. Твердость: Щелочноземельные металлы обладают высокой твердостью, однако они не настолько тверды, как большинство переходных и благородных металлов.
5. Магнитные свойства: Щелочноземельные металлы не проявляют магнитных свойств в чистом виде. Однако некоторые их соединения могут быть магнитными.
Химические свойства

Щелочноземельные металлы обладают рядом химических свойств, которые определяют их поведение в химических реакциях.
Во-первых, щелочноземельные металлы обладают высокой электроотрицательностью и реагируют с водой с образованием щелочно-металлических гидроксидов и выделением водорода газа.
Во-вторых, щелочноземельные металлы способны образовывать соли с кислотами. Они могут образовывать двойные соли, а также комплексные соединения с различными лигандами.
В-третьих, щелочноземельные металлы амфотерны и могут реагировать как с кислотами, так и с щелочами. Они могут образовывать гидроксиды и оксиды, которые обладают щелочными и основными свойствами.
Кроме того, щелочноземельные металлы могут образовывать стабильные комплексы с различными органическими соединениями.
Эти химические свойства щелочноземельных металлов определяют их активность в химических реакциях и их применение в различных областях, включая лечебную медицину, фармакологию, катализ и другие научно-технические отрасли.
Реакция щелочноземельных металлов с водой

Щелочноземельные металлы, такие как магний, кальций и стронций, проявляют химическую реакцию при контакте с водой.
В результате реакции воды с щелочноземельными металлами образуется щелочь и выделяется водородный газ. Реакция протекает очень быстро и сопровождается выделением тепла.
Химическое уравнение для реакции магния с водой: Mg + 2H2O -> Mg(OH)2 + H2. В результате этой реакции образуется гидроксид магния и выделяется водородный газ.
Подобная реакция протекает и с другими щелочноземельными металлами, например, реакция кальция с водой имеет вид: Ca + 2H2O -> Ca(OH)2 + H2.
Реакция щелочноземельных металлов с водой может использоваться в промышленности, например, для получения водородного газа, который затем может использоваться в качестве топлива или сырья для производства различных химических соединений.
Применение

Щелочноземельные металлы широко применяются в различных отраслях науки, техники и промышленности.
Магний, благодаря своей легкости и прочности, используется в авиационной и автомобильной промышленности для производства конструкционных материалов и сплавов. Он также применяется в производстве легких сплавов для создания рамок велосипедов и спортивных автомобилей, а также в производстве пиротехнических смесей.
Кальций находит широкое применение в строительной отрасли для производства цемента и бетона, в металлургии для удаления примесей из сплавов, а также в фармацевтической промышленности для производства лекарственных препаратов и добавок к питанию.
Стронций используется в производстве огнетушителей и световых эмиттеров, таких как телевизоры и компьютерные мониторы. Он также применяется в радиоактивной медицине для лечения рака костей.
Барий находит применение в производстве стекла, электродов для вакуумных ламп и рентгеновских лучей, а также в нефтяной промышленности для подавления образования пены и эмульсий.
Радий, благодаря своей радиоактивности, используется в научных исследованиях и в медицинских целях, а также в промышленности для производства светящихся материалов и приборов.
Вопрос-ответ

Какие металлы относятся к щелочноземельным?
К щелочноземельным металлам относятся бериллий, магний, кальций, стронций, барий и радий.
Чем характеризуются щелочноземельные металлы?
Щелочноземельные металлы характеризуются химической активностью, низкой плотностью, низкой температурой плавления и кипения, а также хорошей проводимостью электричества.
Какова роль щелочноземельных металлов в природе?
Щелочноземельные металлы играют важную роль в природе, так как они являются необходимыми элементами для живых организмов и часто встречаются в минералах и почвах. Они также используются в промышленности и медицине.
Какой химический состав у щелочноземельных металлов?
Химический состав щелочноземельных металлов включает один валентный электрон во внешней оболочке, что дает им выраженную химическую активность. Они образуют ионные соединения с кислородом и галогенами, и образуют соединения с другими элементами.
В чем особенности свойств щелочноземельных металлов?
Особенности свойств щелочноземельных металлов включают низкую плотность и температуру плавления, высокую химическую активность, способность образовывать ионные соединения, а также хорошую проводимость электричества.
