Хлор (Cl) - химический элемент, широко распространенный в природных резервах и широко используемый в промышленности. В периодической системе элементов он находится в группе галогенов и обладает атомным номером 17.
Хлор представляет собой характеристичный желто-зеленый газ с ядовитым запахом. Он очень реактивен и образует соединения с другими элементами, такими как натрий и калий. Хлор имеет высокую электроотрицательность, что делает его хорошим окислителем и способствует его распространению в природных биологических системах, включая океаны и атмосферу.
Не смотря на высокую реактивность и ядовитость, хлор является неметаллом. Он обладает характеристиками неметаллов, такими как слабая электропроводность, низкая теплопроводность и хрупкость. Кроме того, хлор обладает отличительными химическими свойствами, такими как высокий уровень реакции с другими элементами и способность образовывать кислоты.
Вещество Хлор

Хлор - это химический элемент с атомным номером 17 и символом Cl. Он относится к галогенам и является одним из основных элементов природы, наиболее известным как основной ингредиент для производства хлора.
Свойства:
- Химическая активность: Хлор является очень реактивным элементом. Он может легко вступать в химические реакции с другими элементами для образования соединений.
- Физические свойства: Хлор представляет собой желто-зеленый газ с горьким запахом. Он имеет низкую плотность и низкую температуру кипения и замерзания.
- Токсичность: Хлор является ядовитым веществом и может вызывать раздражение дыхательных путей и глаз при вдыхании или контакте с кожей.
- Применение: Хлор широко используется в различных отраслях, включая производство пластиков, дезинфекцию воды, производство химикатов и множество других промышленных процессов.
- Взаимодействие с другими веществами: Хлор реагирует с большинством элементов, образуя стабильные или нестабильные соединения. Он также может реагировать с органическими веществами, образуя токсические хлорорганические соединения.
В целом, хлор является важным химическим элементом, который имеет широкое применение в промышленности и науке, но требует осторожного обращения из-за своей токсичности.
Свойства хлора
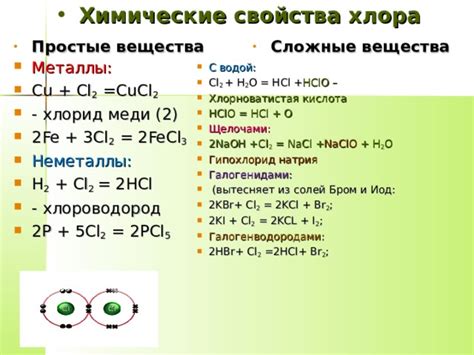
Хлор — это элементарный неметалл из группы галогенов. Он обладает рядом уникальных свойств.
Физические свойства:
- Хлор – желто-зеленый газ, который обладает на холоде характерным запахом. При комнатной температуре и нормальном давлении хлор находится в газообразном состоянии.
- Хлор немного растворяется в воде, образуя кислую среду.
- Температура кипения хлора составляет -34 °C, а точка замерзания -101 °C.
Химические свойства:
- Хлор является очень активным химическим веществом. Он сильный окислитель и реагирует с многими металлами, образуя с ними соединения.
- Хлор проявляет большую активность в реакциях с органическими веществами, что делает его незаменимым ингредиентом в производстве различных соединений.
- Хлор используется в качестве дезинфицирующего средства, благодаря своей способности уничтожать микроорганизмы.
Биологические свойства:
- Взаимодействие хлора с организмом человека может быть опасным, поскольку он является токсичным веществом. В больших концентрациях хлор может вызывать ожоги и раздражение кожи и слизистых оболочек.
- Хлоровые соединения также могут быть ядовитыми и иметь негативное воздействие на организм человека.
В целом, свойства хлора делают его важным элементом в различных областях, таких как химическая промышленность, водоочистка и медицина.
Характеристики хлора
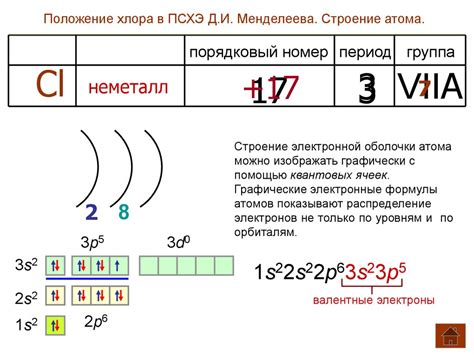
Хлор (Cl) - это химический элемент, принадлежащий к группе галогенов в периодической системе элементов.
Хлор является желтовато-зеленого цвета газом с раздражающим запахом и относится к неметаллам.
Хлор обладает высокой электроотрицательностью, что делает его сильным окислителем.
Хлор образует простые и сложные химические соединения, как с металлами, так и с неметаллами.
Хлор имеет атомный номер 17 и периодический законный символ Cl.
Хлор активно используется в химической промышленности для производства различных продуктов, включая пластик, растворители, пестициды и белизну.
Хлор также используется в обработке воды и для дезинфекции, так как он обладает сильными свойствами уничтожения бактерий.
Хлор является необходимым элементом для жизни и здоровья человека, но при высоких концентрациях или при попадании в организм в неправильной форме, он может быть опасным и вызывать отравление.
В природе хлор обычно встречается в виде солей, таких как хлорид натрия (NaCl) и хлорид калия (KCl).
Хлор - металл или неметалл

Хлор является одним из самых известных и широко используемых химических элементов. Он принадлежит к группе галогенов в периодической системе элементов. Изучение его свойств позволяет сделать вывод, что хлор - неметалл.
Неметаллы обладают рядом характерных свойств, которые характеризуют и хлор. Во-первых, неметаллы обычно не проводят электрический ток. Хлор также является плохим проводником электричества.
Во-вторых, неметаллы образуют ковалентные связи, основанные на обмене электронами между атомами. Хлор образует молекулы, состоящие из двух атомов, объединенных ковалентными связями. Это подтверждает его неметаллическую природу.
Кроме того, хлор является газом при комнатной температуре и атмосферном давлении. Неметаллы обычно находятся в газообразном или жидком состоянии при таких условиях. В случае с хлором, он образует молекулы, которые быстро испаряются при нормальных условиях.
Также стоит отметить, что хлор обладает рядом других характерных свойств неметаллов, таких как высокая электроотрицательность, хрупкость, химическая активность и участие в реакциях окисления.
В целом, свойства и характеристики хлора указывают на его неметаллическую природу. Важно понимать эти особенности для правильного использования и безопасной работы с этим веществом.
Сравнение хлора с другими элементами

Хлор (Cl) — неметалл, относящийся к галогенам в таблице Менделеева. Он имеет атомный номер 17 и отличается от других элементов своей группы, таких как фтор (F), бром (Br) и йод (I), в некоторых своих свойствах.
Хлор образует сильные кислоты, в то время как фтор, бром и йод образуют только слабые кислоты. Кислотность хлороводородной кислоты (HCl) проявляется в ее высоких концентрациях, что делает ее устойчивой к разложению. Кроме того, хлор проявляет меньшую реактивность, чем фтор и бром, что делает его менее опасным в химических реакциях.
Хлор образует множество соединений, таких как соляная кислота (HCl), хлориды металлов (например, натрия, калия), белый неорганический порошок хлорида натрия (NaCl) и множество органических соединений. Фтор, бром и йод также образуют соединения, но их химическая активность обычно выше, чем у хлора.
Хлор является сильным окислителем и может оказывать разрушительное воздействие на органические вещества. Например, он может вызывать ожоги на коже и слизистых оболочках. Фтор также обладает окислительными свойствами, но его действие гораздо более ярко выражено. Бром и йод, наоборот, обычно выступают как агенты восстановления.
Хлор имеет массовое число 35, что делает его одним из самых распространенных изотопов хлора. Фтор, бром и йод имеют другие изотопы с различной массой. Например, фтор имеет массовое число 19, а бром и йод имеют несколько изотопов с массовыми числами 79 и 127 соответственно.
Хлор обладает высокой электроотрицательностью, что делает его сильным возбудителем химических реакций. Фтор, бром и йод также обладают высокими значениями электроотрицательности, что делает их часто взаимодействующими элементами в химических реакциях.
Вопрос-ответ

Какие свойства хлора свидетельствуют о том, что он является не металлом?
Хлор обладает такими характеристиками, как низкая теплопроводность и электропроводность, хрупкость, отсутствие блеска и способность образовывать ковалентные связи. Все эти свойства указывают на его неметаллическую природу.
Можно ли использовать хлор в качестве структурного материала, например, для изготовления прочных конструкций?
Нет, хлор не подходит для использования в качестве структурного материала. Он является газообразным в нормальных условиях и обладает хрупкостью. Кроме того, он не обладает достаточной прочностью, чтобы выдержать механические нагрузки. Вместо этого, хлор используется в различных химических процессах и в промышленности для производства различных соединений.
Какие полезные свойства хлора используют в промышленности?
Хлор является важным сырьем для производства множества продуктов, таких как пластик, резина, хлорированные органические соединения, хлорные растворы воды, дезинфицирующие средства и многие другие. Он также используется в процессе очистки питьевой воды и обеззараживания сточных вод.
Какое вещество образуется при соединении хлора с натрием?
При соединении хлора с натрием образуется хлорид натрия (NaCl) - обычная кухонная соль. Это химическое соединение является неорганическим солью, которая широко используется в пищевой промышленности и как пищевая добавка.
Какие свойства хлора позволяют ему быть эффективным дезинфицирующим средством?
Хлор обладает сильными окислительными свойствами, что делает его эффективным дезинфицирующим средством. Он может уничтожать бактерии, вирусы и другие микроорганизмы, разрушая их клеточные стенки и нарушая их жизненные процессы. Кроме того, хлор обладает широким спектром действия, что делает его одним из наиболее популярных веществ для обеззараживания воды и поверхностей.
