Фосфор - химический элемент с атомным номером 15 и символом P в таблице Mendeleev. Он обладает рядом интересных свойств, в результате чего часто возникает вопрос о его классификации: является ли он металлом или неметаллом?
С одной стороны, фосфор обладает некоторыми признаками металла. Он имеет блеск, проводит тепло и электропроводен при высоких температурах. Кроме того, фосфор способен образовывать ионы с положительным зарядом, что также является характерной особенностью металлов.
Однако, по большинству своих химических и физических свойств, фосфор ближе к неметаллам. Он образует преимущественно отрицательные ионы, соединения фосфора слабо проводят тепло и электричество, а также обладают химической реактивностью, свойственной неметаллам.
Таким образом, можно сделать вывод, что хотя фосфор обладает некоторыми признаками металлов, он в целом классифицируется как неметалл. Его уникальные свойства делают его важным элемнтом в множестве сфер, от сельского хозяйства до химической промышленности.
Фосфор: металл или неметалл?
Фосфор – это химический элемент с атомным номером 15 и обозначением P. Он относится к неметаллам и характеризуется своими особыми свойствами и химическими реакциями.
В чистом виде фосфор представляет собой газообразное вещество, но он может принимать различные аллотропные формы, включая белый, красный и черный фосфор. Белый фосфор является самым стабильным и используется в различных отраслях промышленности, включая производство удобрений и пластмасс.
Фосфор обладает высокой химической активностью и может образовывать соединения с различными элементами. Он является важным компонентом многих органических и неорганических соединений, таких как ДНК, РНК и АТФ.
Однако, несмотря на свои неметаллические свойства, фосфор также может проявлять некоторые металлические свойства. Например, он может образовывать ион P3-, который обладает отрицательным зарядом и может участвовать в образовании солей и комплексных соединений.
Таким образом, фосфор – это химический элемент с неметаллическими свойствами, однако он может проявлять некоторые характеристики металлов. Его уникальные свойства и возможность образования различных соединений делают его важным элементом в химической промышленности и биологических процессах.
Физические свойства фосфора

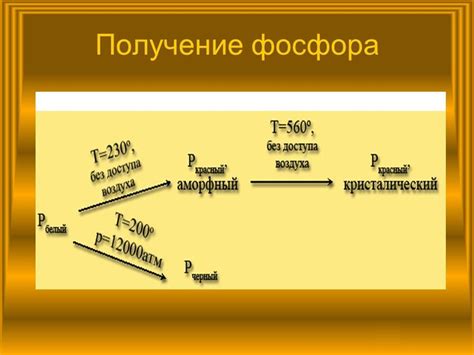
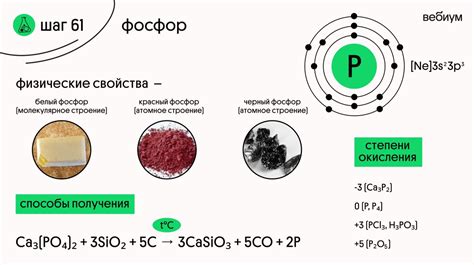
Фосфор - неметаллический химический элемент с атомным номером 15 и символом Р. Он принадлежит к группе пниктогенов и может существовать в различных формах, включая белый, красный и черный фосфор.
Белый фосфор обладает ядовитыми свойствами и является самой распространенной формой фосфора. Он прозрачен и передает свет, но его аллотропный вид обладает характеристикой фосфоресценции, излучая бледно-зеленый свет. Белый фосфор также очень реакционен и может воспламеняться при контакте с воздухом, поэтому его хранят под водой или в соляной кислоте.
Красный фосфор является более стабильной формой фосфора и имеет темно-красный цвет. Он не растворяется в воде и нереактивен с кислородом. Красный фосфор применяется в производстве селитры, матчей и фосфорных красителей.
Черный фосфор является самой нестабильной формой фосфора. Он обладает металлическим оттенком и может быть получен путем нагревания белого фосфора в вакууме. Черный фосфор обладает полупроводниковыми свойствами и может использоваться в электронике и оптике.
Кроме того, фосфор является нелигируемым элементом и не растворяется в большинстве растворителей. Он имеет высокую термоэлектроэмиссию и используется в производстве катодов для телевизоров и рентгеновских трубок.
Химические свойства фосфора

Фосфор – химический элемент, обладающий множеством уникальных химических свойств. При комнатной температуре фосфор существует в виде твёрдого вещества, имеющего светлую желтую или белую окраску. Химический символ фосфора – P, а его атомный номер равен 15.
Одним из основных химических свойств фосфора является его способность осуществлять реакции окисления. При контакте с кислородом плавящийся белый фосфор горит, выделяя интенсивное желтое пламя. Это свойство позволяет использовать фосфор в производстве спичек и пиротехнических изделий.
Химическая активность фосфора и его способность образовывать соединения с различными элементами делают его важным компонентом во многих химических соединениях. Например, фосфор образует соли, такие как фосфаты, которые являются важными веществами для многих живых организмов, включая растения и животных.
Еще одной интересной особенностью фосфора является его способность образовывать многочисленные модификации или аллотропные формы. Одной из самых известных аллотропных форм фосфора является красный фосфор, который имеет тёмно-красную окраску и обладает другими химическими свойствами по сравнению с белым фосфором.
Таким образом, химические свойства фосфора делают его уникальным элементом, имеющим широкое применение в различных областях, от медицины и сельского хозяйства до пиротехники и пластмассовой промышленности.
Распространение фосфора в природе

Фосфор — один из наиболее распространенных химических элементов в земной коре. Его содержание в земле составляет около 0,1%.
Источником фосфора в природе являются его минеральные соединения, такие как апатиты, которые встречаются в различных геологических образованиях.
Также фосфор находится в органических соединениях, главным образом в растениях и животных.
Фосфор присутствует в большинстве горных пород и отложений, таких как фосфоритовые, гипсовые и известковые промышленные скальные породы.
Однако его концентрация в различных регионах мира может быть разной.
Наибольший объем фосфора в природе связан с его содержанием в морских отложениях и осадках. Такие отложения возникают в результате
осаждения гидрокарбонатов и фосфатов кальция, образующихся за счет жизнедеятельности морских организмов.
Фосфор является важным элементом для жизни на Земле, поскольку входит в состав органических соединений, таких как ДНК и АТФ.
Он также является неотъемлемым элементом для роста и развития растений, так как является основным компонентом фосфорных удобрений.
Применение фосфора в различных отраслях
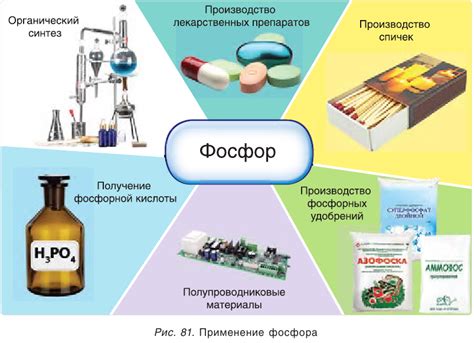
1. Химическая промышленность:
В химической промышленности фосфор находит широкое применение. Он используется в производстве удобрений, красителей, огнезащитных и гербицидных средств. Фосфорные соединения также часто используются в производстве пластмасс, лаков, красок и прочих химических продуктов. Без фосфора многие процессы в химической промышленности были бы невозможны.
2. Электронная промышленность:
Фосфор является неотъемлемой частью процесса производства полупроводников и электронных компонентов. Он используется в производстве полупроводниковых материалов, таких как германаты и фосфаты. Фосфорная кислота используется в процессе гравирования кремниевых пластин для создания микросхем и других электронных устройств.
3. Металлургия:
В металлургической промышленности фосфор используется для улавливания примесей во время процесса выплавки стали. Фосфор применяется для дезоксидации железа и повышения его пластичности. Фосфористые добавки помогают улучшить качество стали и придать ей специфические свойства.
4. Военная промышленность:
Фосфорные соединения широко используются в военных технологиях. Фосфорные комбинации используются для создания ложных целей и различных затеняющих композиций. Также фосфор может быть использован в качестве подрывного или самовоспламеняющегося вещества.
5. Сельское хозяйство:
Фосфорные удобрения являются одними из важнейших компонентов для повышения плодородия почвы. Фосфор содействует нормальному росту и развитию растений, а также обеспечивает устойчивость к болезням. Без фосфора сельское хозяйство не смогло бы обеспечить достаточные поставки продовольствия для населения.
Вредные свойства фосфора
Фосфор имеет несколько вредных свойств, связанных с его химической активностью и токсичностью. Одно из таких свойств - его способность к самовоспламенению на воздухе при комнатной температуре. Это делает его крайне опасным в обращении и хранении, поскольку малейшее воздействие воздуха может вызвать вспыхивание и возгорание вещества.
Фосфор также является ядовитым веществом. В чистом виде он может вызвать ожоги кожи и слизистых оболочек и оказывать токсическое воздействие на организм при вдыхании его паров или попадании внутрь через пищеварительную систему. Первые признаки отравления фосфором могут быть в виде тошноты, головной боли, расстройства пищеварения и слабости. При длительном воздействии может развиться фосфорное отравление, сопровождающееся значительным повреждением печени, почек и костей.
Еще одним вредным свойством фосфора является его способность вызывать экологическую угрозу. Попадая в почву и воду с выхлопными газами от промышленных предприятий или из отработанных удобрений, фосфор может вызывать разрушение экосистем, загрязнение водных ресурсов и нарушение природного равновесия.
Вопрос-ответ

Какие свойства фосфора относят его к металлам?
Фосфор обладает несколькими свойствами, которые позволяют отнести его к металлам. Во-первых, фосфор является твердым веществом при комнатной температуре. Во-вторых, он обладает металлическим блеском и хорошо проводит электричество. Кроме того, фосфор обладает высокой пластичностью и деформируется без разрушения. Все эти свойства указывают на то, что фосфор является металлом.
Почему фосфор считается неметаллом?
Несмотря на некоторые металлические свойства, фосфор в целом считается неметаллом. Это связано с тем, что фосфор обладает низкой температурой плавления и высокой хрупкостью при низких температурах. Он не обладает магнитными свойствами и не образует положительный ион в растворах. Кроме того, фосфор образует ковалентные соединения с другими элементами, что является характеристикой неметаллов. Все эти особенности позволяют отнести фосфор к неметаллам.
Могут ли свойства фосфора противоречить его классификации как металла или неметалла?
Да, некоторые свойства фосфора могут вызывать некоторые противоречия в его классификации. Например, наличие металлического блеска и способность проводить электричество могут указывать на его металлические свойства. Однако, низкая температура плавления и хрупкость при низких температурах говорят в пользу классификации фосфора как неметалла. Кроме того, образование ковалентных соединений также указывает на его неметаллические свойства. Поэтому можно сказать, что свойства фосфора могут противоречить его классификации, но в целом они подтверждают его статус неметалла.
