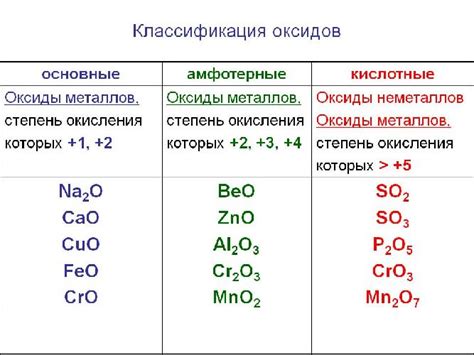
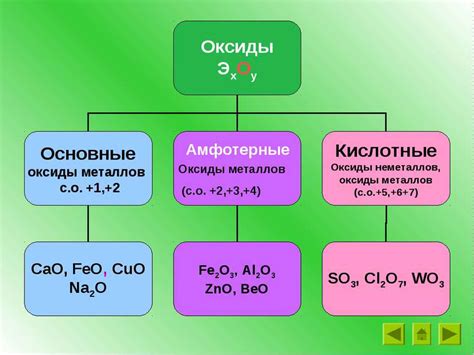
Оксиды щелочноземельных металлов представляют собой химические соединения, состоящие из кислорода и металлического элемента группы II периодической системы. В зависимости от своих свойств оксиды щелочноземельных металлов могут быть классифицированы как кислотные, амфотерные или основные соединения.
Кислотные оксиды щелочноземельных металлов характеризуются тем, что они образуют кислоты при взаимодействии с водой. Такие оксиды имеют сильно кислотные свойства и способны реагировать с основаниями, образуя соли. Примером кислотного оксида является оксид кальция (CaO), который при контакте с водой образует щелочь кальциевую.
Амфотерные оксиды щелочноземельных металлов могут образовывать как соли с кислотными свойствами, так и с соли с основными свойствами. Такие оксиды могут взаимодействовать и реагировать как с кислотами, так и с щелочами. Примером амфотерного оксида является оксид алюминия (Al2O3), который может взаимодействовать как с кислотами, образуя соли, так и с щелочами, образуя гидроксиды.
Основные оксиды щелочноземельных металлов обладают выраженными щелочными свойствами и образуют щелочные растворы при взаимодействии с водой. Такие оксиды являются производными щелочных оксидов, образующихся при окислении щелочных металлов. Примером основного оксида является оксид бария (BaO), который при взаимодействии с водой образует щелочь бария.
Характер оксидов щелочноземельных металлов
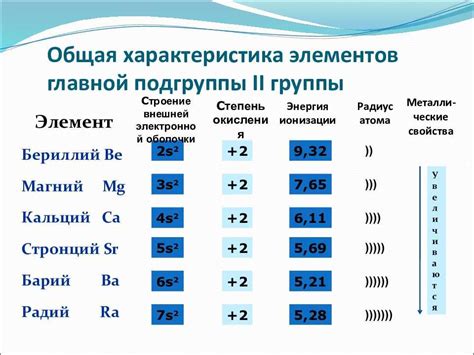
Оксиды щелочноземельных металлов - это химические соединения, состоящие из металлического элемента щелочноземельной группы и кислорода. Они обладают разными характерами в зависимости от конкретного металла и его оксидации.
Бериллий-оксид (BeO) является кислотным оксидом. Он реагирует с водой, образуя кислотный раствор. Магний-оксид (MgO) и кальций-оксид (CaO) также обладают кислотным характером. Они реагируют с водой, образуя гидроксиды, которые могут растворяться в воде и образовывать щелочные растворы.
Стронций-оксид (SrO) и барий-оксид (BaO) являются амфотерными оксидами. Это означает, что они могут реагировать как с кислотами, так и с щелочами. При взаимодействии с щелочью, они образуют соли, а с кислотой - соответствующий солевой ангидрид.
Радий-оксид (RaO) и оксиды остальных щелочноземельных металлов, такие как цезий-оксид (CsO), франций-оксид (FrO), являются основными оксидами. Они реагируют с водой, образуя щелочные растворы, и могут образовывать соли с кислотами.
Таким образом, оксиды щелочноземельных металлов могут быть кислотными, амфотерными или основными в зависимости от своего химического характера и взаимодействия с другими веществами.
Кислотный оксид
Кислотный оксид – это оксид щелочноземельного металла, который обладает кислотными свойствами в реакции с водой. Он способен образовывать кислоты, которые в свою очередь реагируют с основаниями, образуя соль и воду.
Кислотные оксиды имеют высокую электроотрицательность и способны отдавать протоны в реакции с водой. Такие оксиды, например оксид кальция (CaO) или оксид магния (MgO), растворяются в воде, образуя гидроксиды щелочноземельных металлов.
Кислотные оксиды также могут реагировать с кислотой, образуя соль. Например, оксид кальция реагирует с соляной кислотой, образуя хлорид кальция и воду. Такие реакции позволяют использовать кислотные оксиды в промышленности для синтеза различных веществ.
Амфотерный оксид
Амфотерный оксид – это оксид, который может проявлять свойства как кислотного, так и основного характера в зависимости от реакции с другими веществами или окружающей средой. Такие оксиды обладают способностью реагировать как с кислотами, так и с щелочами.
Амфотерные оксиды щелочноземельных металлов характеризуются наличием электрондефицитного металла, который образует слабощелочную среду, и неэлектрондефицитного кислорода, образующего слабокислую среду. В результате такого сочетания свойств, амфотерные оксиды могут взаимодействовать с кислотами и образовывать с ними соли, а также реагировать с щелочами и образовывать основания.
Примером амфотерного оксида является оксид алюминия (III) (Al2O3), который взаимодействует с кислотными соединениями, образуя соли, и с щелочами, образуя основания. Амфотерные оксиды широко применяются в различных отраслях промышленности, включая производство керамики, стекла, катализаторов и лекарственных препаратов.
Вопрос-ответ

В чем заключается характер оксидов щелочноземельных металлов?
Характер оксидов щелочноземельных металлов может быть кислотным, амфотерным или основным.
Каков характер оксидов щелочноземельных металлов?
Характер оксидов щелочноземельных металлов зависит от взаимодействия оксида с водой или кислотами. Некоторые оксиды образуют кислотные растворы, другие - щелочные растворы, а некоторые могут реагировать как кислоты и щелочи, то есть иметь амфотерный характер.
Какие бывают характеры оксидов щелочноземельных металлов?
Оксиды щелочноземельных металлов могут иметь кислотный, щелочной или амфотерный характер. Кислотные оксиды образуют кислотные растворы при растворении в воде, щелочные оксиды - щелочные растворы, а амфотерные оксиды могут реагировать и с кислотами, и с щелочами.
Что определяет характер оксидов щелочноземельных металлов?
Характер оксидов щелочноземельных металлов определяется электрохимическими свойствами. Если оксид обладает кислотными свойствами, он может реагировать с щелочами, образуя соль и воду. Если оксид обладает щелочными свойствами, он может реагировать с кислотами, образуя соль и воду. Амфотерные оксиды могут реагировать как с кислотами, так и с щелочами, образуя соли и воду.
