Оксиды металлов - это химические соединения, состоящие из металлического элемента и кислорода. Эти соединения имеют важное значение в химии и промышленности, так как они широко применяются в качестве катализаторов, пигментов, материалов для создания электродов и прочего.
Химические особенности оксидов металлов определяются их структурой и валентностью металла. Оксиды металлов могут быть как ионными, так и ковалентными соединениями. В ионной структуре кислородные атомы образуют отрицательно заряженные оксидные ионы, а металлические ионы располагаются в решетке оксида. В ковалентной структуре кислородные атомы образуют ковалентные связи с металлическими атомами.
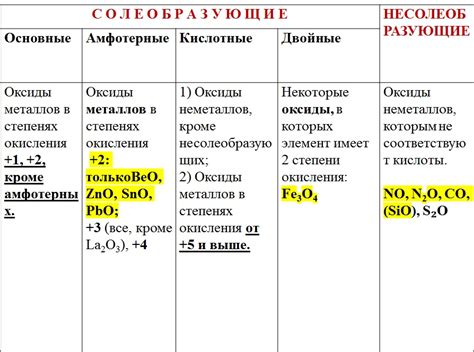
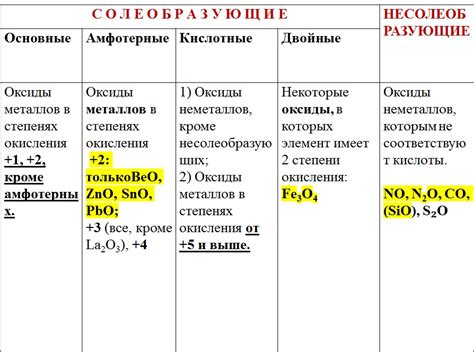
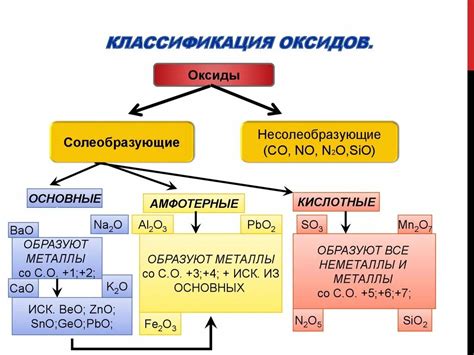
Оксиды металлов обладают различной степенью кислотности. Некоторые оксиды металлов, например, оксиды щелочных металлов, обладают выраженными основными свойствами и растворяются в кислотах с образованием солей. Другие оксиды являются амфотерными и могут проявлять и кислотные, и основные свойства в зависимости от условий реакции. Есть также оксиды, которые обладают ярко выраженными кислотными свойствами и реагируют с основаниями, образуя соли и воду.
Химические свойства оксидов металлов
Оксиды металлов – это неорганические соединения, состоящие из кислорода и металла. Они обладают разнообразными химическими свойствами, которые варьируются в зависимости от типа металла и его окисления.
Оксиды металлов являются основными соединениями металлов и кислорода. Они обладают высокой химической активностью и часто реагируют с водой, кислотами и другими веществами. Некоторые оксиды металлов образуют щелочные растворы, которые имеют основные свойства.
Оксиды металлов могут образовывать соли с кислотами, образуя оксозоли. Например, оксид натрия (Na₂O) реагирует с соляной кислотой (HCl) и образует соль – хлорид натрия (NaCl) и воду (H₂O). Эта реакция позволяет использовать оксиды металлов в производстве различных химических соединений.
Некоторые оксиды металлов могут образовывать основания, реагируя с водой. Например, оксид калия (K₂O) реагирует с водой (H₂O) и образует гидроксид калия (KOH). Гидроксиды металлов являются сильными основаниями и широко используются в промышленности и лаборатории.
Одним из важных химических свойств оксидов металлов является их взаимодействие с кислородом. Некоторые оксиды металлов могут реагировать с кислородом при нагревании, образуя пероксиды. Например, оксид бария (BaO) при нагревании в атмосфере кислорода превращается в пероксид бария (BaO₂). Это применяется в производстве материалов для химических реакций и определенных катализаторов.
Оксиды металлов: определение и общие характеристики

Оксиды металлов - это химические соединения, образующиеся при реакции металла с кислородом. Они являются основными компонентами веществ, которые мы ежедневно встречаем в окружающей среде, таких как земля, камни, песок и другие минералы.
Оксиды металлов обладают уникальными свойствами, которые определяют их химическую активность и физические характеристики. Большинство оксидов металлов являются твердыми веществами с высокой температурой плавления и кипения. Они обычно обладают хорошей электропроводностью и теплопроводностью.
Оксиды металлов могут быть кислотными или основными, в зависимости от свойств кислотности-основности окислительного и восстановительного вещества. Кислотные оксиды образуют кислоты при реакции с водой, а основные оксиды образуют щелочи.
Оксиды металлов также могут иметь различные окислительные состояния, что определяется числом валентности металла. Например, железо может образовывать оксиды с различным количеством кислорода и разными свойствами.
Оксиды металлов широко используются в промышленности и научных исследованиях благодаря их уникальным свойствам и возможностям взаимодействия с другими веществами. Они играют важную роль в металлургии, катализе, электрохимии и других отраслях науки и промышленности.
Оксидационные состояния металлов и их влияние на химические свойства оксидов
Оксиды – это соединения, состоящие из кислорода и металла. Они формируются при окислении металлов, когда они взаимодействуют с кислородом воздуха или воды. Каждый металлспособен образовывать различные оксиды, так как он может находиться в разных оксидационных состояниях.
Оксидационное состояние металла определяет его степень окисления в соединении. Чаще всего металлы образуют оксиды с положительным окислением, но некоторые металлы также способны образовывать оксиды с отрицательным окислением. Например, железо может образовывать как Fe2+ (железо(II) оксид), так и Fe3+ (железо(III) оксид).
Оксидационное состояние металла оказывает существенное влияние на химические свойства образующихся оксидов. С одной стороны, чем выше окислительность металла (больше положительное окисление), тем большую степень окисления имеет оксид, а значит, сильнее его восстановительные свойства. С другой стороны, металлы с отрицательным окислением в своих оксидах обычно демонстрируют химическую активность в реакциях с оксидами металлов положительной окислительной способности.
Также важно отметить, что оксиды металлов с разными окислительными состояниями обладают разными физическими свойствами. Например, оксиды металлов с меньшими окислительными состояниями обычно имеют низкую температуру плавления и являются электролитами, тогда как оксиды металлов с большими окислительными состояниями обладают высокой температурой плавления и не являются электролитами.
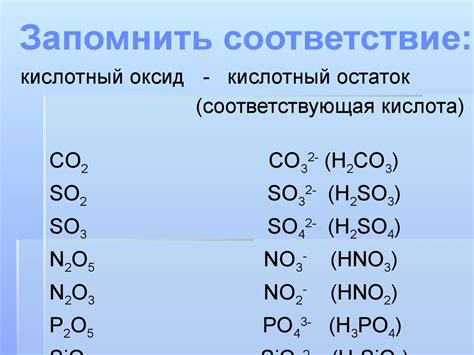
Кислотные оксиды: свойства и применение
Кислотные оксиды – это оксиды, которые при реакции с водой образуют кислоты. Они обладают способностью давать кислотные растворы, проявляя кислотные свойства. К этой группе относятся, например, диоксид серы (SО2), азота (NО2) и фосфора (P2О5).
Среди основных свойств кислотных оксидов стоит отметить их кислотность, токсичность и коррозионную активность. Они способны вызывать реакцию с кожей и слизистыми оболочками, а также приводить к коррозии металлов при контакте.
Использование кислотных оксидов может быть разнообразным. В промышленности они широко применяются в процессах производства кислот, солей и других химических соединений. Например, диоксид серы используется для производства серной кислоты и сульфата меди. Оксиды азота находят применение в производстве азотной кислоты, удобрений и строительных материалов. Оксид фосфора используется в производстве фосфорной кислоты и удобрений.
Однако необходимо быть осторожным при работе с кислотными оксидами, так как они могут вызывать раздражение глаз и дыхательных путей, а также приводить к серьезным ожогам и повреждению органов при попадании на кожу или внутрь организма. При работе с кислотными оксидами необходимо соблюдать соответствующие меры безопасности и использовать защитное снаряжение.
Основные оксиды: особенности и практическое применение
Оксиды металлов - это химические соединения, состоящие из металлического элемента и кислорода. Среди них существуют различные классы оксидов, однако основные оксиды являются самыми распространенными и важными в химической промышленности и повседневной жизни.
Основные оксиды имеют способность растворяться в воде, образуя щелочные растворы. Они обладают щелочной реакцией из-за наличия ионов гидроксида в своей структуре. Эти растворы обладают различными полезными свойствами и широко используются в различных отраслях промышленности и научных исследованиях.
Практическое применение основных оксидов разнообразно. Одним из наиболее распространенных применений является использование основных оксидов в производстве щелочей, таких как натрийная гидроксид и калиевая гидроксид. Эти вещества широко используются в процессах синтеза органических и неорганических соединений, в производстве бумаги, мыла, стекла и других продуктов.
Основные оксиды также находят применение в процессе гальванического покрытия металлов. Они используются в электролизе для создания оксидных покрытий на поверхности металла, которые обладают повышенной стойкостью к коррозии и механическим воздействиям. Это делает металлы более долговечными и эстетичными.
Еще одним применением основных оксидов является их использование в качестве катализаторов. Они способны ускорять химические реакции, не участвуя в них непосредственно. Это важно в процессах производства пластмасс, водородных топливных элементов и других продуктов, где требуется повышенная скорость реакции и эффективность процесса.
В целом, основные оксиды металлов являются важными соединениями с широким спектром применения. Они играют важную роль не только в промышленности, но и в науке и повседневной жизни, обеспечивая надежность, эффективность и функциональность различных процессов и продуктов.
Амфотерность оксидов: механизм и проявления

Амфотерность - это способность вещества взаимодействовать как с кислотами, так и с щелочами. Механизм амфотерного действия оксидов металлов основан на их способности принимать и отдавать протоны (H+). Благодаря этому, оксиды металлов могут проявлять кислотные или щелочные свойства, в зависимости от условий реакции.
Амфотерность оксидов металлов обусловлена их строением и способностью образовывать ионы. Например, оксиды алюминия, цинка, железа и многих других могут реагировать как с кислотами, так и с щелочами.
В результате реакции с щелочами, амфотерные оксиды образуют соли щелочных металлов и воду. Например, оксид алюминия (Al2O3) в реакции с щелочью натрия (NaOH) образует соль натрия и воду: Al2O3 + 6NaOH -> 2Na3AlO3 + 3H2O.
В реакции с кислотами амфотерные оксиды образуют соли кислот и воду. Например, оксид железа (Fe2O3) в реакции с соляной кислотой (HCl) образует соль железа и воду: Fe2O3 + 6HCl -> 2FeCl3 + 3H2O.
Таким образом, амфотерные оксиды проявляют свои способности не только в химических реакциях, но и в ежедневной жизни. Они применяются, например, в производстве шампуней и других косметических средств, а также в производстве стекла и керамики.
Переходные оксиды и их химические свойства
Переходные оксиды – это оксиды переходных металлов, которые имеют особые химические свойства. Они образуются в результате взаимодействия переходных металлов с кислородом. Эти оксиды обладают разнообразными физическими и химическими свойствами, что делает их весьма интересными объектами исследования.
Химические свойства переходных оксидов зависят от типа переходного металла и его степени окисления. Некоторые переходные оксиды обладают кислотными свойствами и реагируют с основаниями, образуя соли. Другие оксиды могут проявлять щелочные свойства и реагировать с кислотами, образуя соли и воду.
Например:
- Оксид железа (III) Fe2O3 проявляет амфотерные свойства, то есть может реагировать как с кислотами, так и с основаниями.
- Оксид меди (II) CuO реагирует с кислотами, образуя сульфат меди и воду.
- Оксид хрома (VI) CrO3 обладает кислотными свойствами и может реагировать с щелочами, образуя хроматы и воду.
Помимо этого, переходные оксиды также проявляют окислительные или восстановительные свойства, что важно во многих химических процессах. Некоторые из них могут взаимодействовать с другими соединениями, образуя сложные комплексы, которые широко применяются в различных областях науки и промышленности.
Таким образом, переходные оксиды представляют собой уникальные химические соединения, которые имеют разнообразные свойства и находят применение в различных сферах деятельности человека.
Сложные оксиды металлов: структура и применение

Сложные оксиды металлов – это соединения металлов, в которых в структуре оксида присутствуют другие элементы, помимо кислорода. Они имеют сложную кристаллическую структуру и обладают уникальными свойствами, которые находят широкое применение в различных областях.
Одним из самых известных примеров сложных оксидов металлов является перовскит – соединение, которое образуется из оксида кальция и ниобия. Оно имеет формулу CaTiO3 и обладает высокой электропроводностью. Поэтому перовскит используется в производстве твердотельных аккумуляторов и солнечных панелей.
Еще одним интересным примером сложных оксидов металлов являются спиновые оксиды. Они обладают особенностью – электроны в их структуре образуют так называемые "спины", которые могут быть направлены в разные стороны. Благодаря этому свойству спиновые оксиды находят применение в магнитных материалах, таких как жесткие диски, магнитные ленты и магнитооптические диски.
Также стоит отметить применение сложных оксидов металлов в катализе. Они могут использоваться в качестве катализаторов для реакций окисления-восстановления и в процессах синтеза органических соединений. Некоторые сложные оксиды металлов, например, оксид ванадия, обладают фотохимическими свойствами и применяются в фотокатализе.
В итоге, сложные оксиды металлов представляют собой важные соединения, которые находят широкое применение в различных областях науки и техники. Их уникальные свойства и структура позволяют использовать их как функциональные материалы в электронике, энергетике, катализе и других технологических процессах.
Вопрос-ответ

Какие основные свойства оксидов металлов?
Оксиды металлов обладают такими химическими свойствами как растворимость в воде, щелочность или кислотность, способность взаимодействовать с другими веществами. Они также обладают разной степенью окислительности, что определяет их реакционную способность.
Могут ли оксиды металлов вступать в реакцию с водой?
Да, многие оксиды металлов взаимодействуют с водой, образуя основания или кислоты в зависимости от своей химической природы. Некоторые оксиды металлов растворяются в воде и образуют гидроксиды, которые могут исполнять свою функцию как основания.
Можно ли классифицировать оксиды металлов по их реакционной способности?
Да, оксиды металлов можно классифицировать на основе их реакционной способности. Некоторые оксиды металлов являются кислотными, то есть они реагируют с водой, образуя кислоту. Другие оксиды металлов могут быть щелочными или амфотерными, то есть они могут взаимодействовать как с кислотами, так и с основаниями.
Какое значение имеет окислительная способность оксидов металлов?
Оксиды металлов обладают разной степенью окислительности, что определяет их реакционную способность. Оксиды с высокой окислительной способностью могут выступать в качестве окислителей и окислять другие вещества, тогда как оксиды с низкой окислительной способностью могут выступать в качестве восстановителей и восстанавливать другие вещества.
Какое значение имеет pH оксидов металлов?
Оксиды металлов, которые растворяются в воде и образуют основания, имеют щелочную реакцию, а значит, их pH будет выше 7. Некоторые оксиды металлов могут растворяться в воде и образовывать кислоты, а значит, их pH будет ниже 7. Однако, не все оксиды металлов растворяются в воде и изменяют pH.
