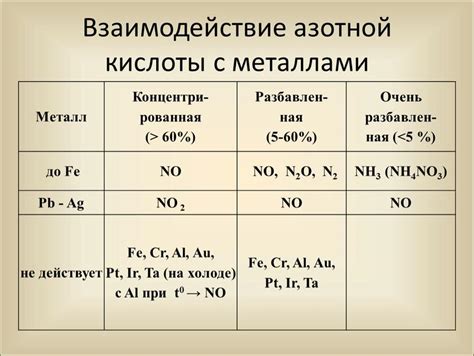
Азотная кислота - важное химическое соединение, которое широко используется в промышленности и научных исследованиях. Однако, взаимодействие азотной кислоты с металлами имеет особое значение, так как приводит к различным химическим реакциям и изменению свойств растворов.
Взаимодействие металлов с азотной кислотой может привести к реакциям окисления и образованию солей. Некоторые металлы способны активно разложить азотную кислоту, освобождая диоксид азота и воду. Эта реакция характеризуется энергетической выгодностью и происходит с участием катализаторов, таких как металлы.
Например, алюминий, железо или медь могут сильно реагировать с азотной кислотой, что проявляется в характерном испускании газов и изменении цвета раствора. Это обусловлено тем, что данные металлы имеют высокую активность и связываются с азотной кислотой, осуществляя окислительно-восстановительные реакции.
Важно отметить, что химические реакции между металлами и азотной кислотой могут быть опасными и необходимо соблюдать меры предосторожности. Кроме того, результаты таких реакций могут быть полезными для производства различных соединений и материалов.
Таким образом, изучение влияния металлов на растворы азотной кислоты позволяет более полно понять свойства и возможности этого соединения, а также развивать новые технологии и материалы в различных областях науки и промышленности.
Окисление металлов азотной кислотой

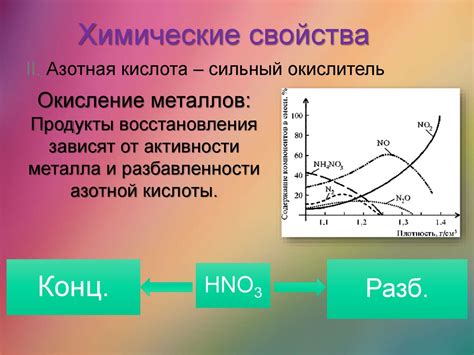
Окисление металлов азотной кислотой является одним из важных химических процессов существующих в химической науке. Азотная кислота (HNO3) обладает сильными окислительными свойствами благодаря своей составной природе. В процессе окисления металла азотная кислота выступает как окислитель, передавая свои кислородные атомы металлу.
Окисление металлов азотной кислотой может протекать по разным механизмам, в зависимости от свойств металла и концентрации азотной кислоты. Некоторые металлы, такие как медь (Cu), железо (Fe) и свинец (Pb), могут быть окислены азотной кислотой при комнатной температуре, при этом происходит выделение оксида азота и образование соответствующих металлических нитратов.
Однако, сильное окислительное действие азотной кислоты может вызывать коррозию металлов. Особенно это касается железа и его сплавов, которые под влиянием азотной кислоты становятся хрупкими и теряют свою прочность. Поэтому, при работе с азотной кислотой необходимо соблюдать особую осторожность и применять соответствующие меры безопасности.
Формирование азотсодержащих соединений
Металлы могут вступать в химическую реакцию с азотной кислотой, что приводит к образованию различных азотсодержащих соединений. Эти соединения могут иметь различные свойства и широко применяться в различных областях науки и технологии.
Одним из продуктов реакции металлов с азотной кислотой являются нитраты металлов. Нитраты обладают высокой растворимостью в воде и широко используются в качестве удобрений, продуктов питания, исходных веществ для получения других химических соединений. Они также используются в производстве взрывчатых веществ и пиротехники.
Кроме нитратов, при реакции металлов с азотной кислотой могут образовываться и другие соединения, такие как аммиак, гидрантные формы азотной кислоты (гидрогеннитраты), азотистые кислоты, азотоксиды и другие. Каждое из этих соединений имеет свои особенности и применение в различных сферах.
Формирование азотсодержащих соединений при реакции металлов с азотной кислотой может происходить как с выделением тепла и газов, так и без них. Важно учитывать, что при работе с азотной кислотой и ее соединениями необходимо соблюдать меры безопасности, так как эти вещества могут быть ядовитыми и опасными при неправильном использовании.
Таким образом, влияние металлов на растворы азотной кислоты приводит к формированию различных азотсодержащих соединений с разнообразными свойствами и областями применения. Изучение этих реакций позволяет расширить наше понимание о возможностях и характеристиках металлов и азотных соединений, а также применять их в различных областях науки и технологии.
Взаимодействие металлов и азотной кислоты: образование нитратов
Азотная кислота, или HNO3, является одной из наиболее распространенных кислот в химии. Она активно взаимодействует с металлами, образуя нитраты – соли азотной кислоты. Этот процесс имеет важное промышленное применение в производстве удобрений, взрывчатых веществ, а также в лабораторных исследованиях.
Во время взаимодействия металлов с азотной кислотой происходят несколько химических реакций. Сначала идет процесс окисления металла кислородом из азотной кислоты. При этом азотная кислота превращается в азотоводородную соль – гидроксид азотистого аммония, или NH4NO2.
Затем происходит дальнейшее окисление гидроксида азотистого аммония до нитрата. В результате этой реакции образуется азотная кислота, оксид каждого металла и нитрат металла. Полученные нитраты остаются в растворе и могут быть использованы для различных целей.
Не все металлы одинаково активно взаимодействуют с азотной кислотой. Некоторые металлы, такие как железо, алюминий и медь, проявляют высокую активность и быстро окисляются. Другие металлы, такие как золото и платина, образуют стабильные оксиды и не реагируют с азотной кислотой. При этом металлические нитраты обладают разными свойствами и могут быть использованы в различных отраслях промышленности.
Токсичность азотных соединений металлов
Азотные соединения металлов могут быть токсичными и имеют потенциальный негативный воздействие на организм человека и окружающую среду. Эти соединения могут образовываться в результате химических реакций между металлами и азотной кислотой.
Одним из наиболее распространенных азотных соединений металлов является нитрат. Нитраты могут образовываться при окислении металлических ионов азотной кислотой. Также нитраты представляют собой основной источник азота для многих растений. Однако высокая концентрация нитратов может быть вредна для человека. Постоянное потребление пищи, загрязненной нитратами, может привести к различным заболеваниям, таким как метгемоглобинемия.
Другим важным азотным соединением металлов является аммиак. Аммиак используется в промышленности для производства удобрений и веществ, используемых в процессе очистки воды и сточных вод. Однако в больших количествах аммиак может быть токсичным. Постоянное вдыхание паров аммиака может вызывать раздражение дыхательных путей, повреждение легких и нервной системы.
Таким образом, важно обращать внимание на концентрацию азотных соединений металлов в окружающей среде и контролировать их уровень, чтобы предотвратить возможные негативные последствия для здоровья человека и окружающей среды.
Применение металлов в химической промышленности: катализаторы и реактивы

Металлы широко используются в химической промышленности в качестве катализаторов и реактивов. Они играют важную роль в химических реакциях, ускоряя процесс превращения одних веществ в другие.
Катализаторы, содержащие металлы, используются в различных процессах, например, при производстве пластиков, удобрений, синтезе органических соединений. Медь, платина, рутений и другие металлы в виде наночастиц активно способствуют химическим реакциям, увеличивая их скорость и эффективность.
Реактивы, содержащие металлы, также применяются в химической промышленности. Металлические соединения могут служить источниками металлов, необходимых для различных процессов. Например, оксид алюминия используется в производстве катализаторов, а хлорид железа – в процессах окисления и гидратации.
Металлы представляют большой интерес для химической промышленности благодаря своим уникальным свойствам и возможностям. Использование металлов в виде катализаторов и реактивов позволяет ускорить процессы, улучшить качество продукции и снизить затраты на производство. Это делает металлы незаменимыми в химической промышленности и придает им огромное значение для различных отраслей промышленности.
Вопрос-ответ

Какие металлы реагируют с азотной кислотой?
С азотной кислотой могут реагировать различные металлы, такие как железо, цинк, медь и алюминий.
Какие химические реакции происходят при взаимодействии металлов с азотной кислотой?
Взаимодействие металлов с азотной кислотой может приводить к различным реакциям, включая образование оксидов, нитратов и аммиака.
