Оксиды металлов - это химические соединения, состоящие из металлического элемента и кислорода. Взаимодействие этих соединений с водой играет важную роль в химических процессах и имеет множество применений в различных отраслях науки и промышленности.
Одним из основных принципов взаимодействия воды с оксидами металлов является образование кислот или оснований. Если оксид металла растворяется в воде, он может присоединиться к одному или двум молекулам воды, образуя кислоту или основание соответственно. Такие реакции называются гидратацией и могут происходить как сильно экзотермически, так и эндотермически.
Взаимодействие воды с оксидами металлов может быть использовано для получения водорода и управления pH-значением растворов. Например, реакция алюминия с гидроксидом натрия дает натрий-алюминиевый гидроксид и высвобождает водород. Этот процесс широко используется в производстве водорода, который является важным сырьем для различных отраслей промышленности.
В целом, взаимодействие воды с оксидами металлов является одной из основных химических реакций, которые определяют поведение металлов в различных средах. Изучение этих реакций позволяет лучше понять и контролировать множество химических и физических свойств оксидов металлов, что имеет практическое значение для создания новых материалов и разработки технологических процессов.
Взаимодействие воды с оксидами металлов

Взаимодействие воды с оксидами металлов является одним из важных процессов в химии. При этом образуются соответствующие гидроксиды и возникают различные химические реакции. Вода может реагировать как с оксидами щелочных металлов, так и с оксидами переходных металлов.
Взаимодействие воды с оксидами щелочных металлов, таких как натрий, калий, литий, происходит с образованием щелочных гидроксидов. Например, реакция кислорода с натрием дает оксид натрия:
- Na + O2 ⟶ Na2O
Этот оксид натрия в дальнейшем может реагировать с водой:
- Na2O + H2O ⟶ 2NaOH
Таким образом, в результате реакции вода и оксид натрия образуют гидроксид натрия (натриевую щелочь).
С оксидами переходных металлов, таких как железо, медь, никель, взаимодействие с водой происходит иначе. Вода и оксид переходного металла могут реагировать с образованием различных гидроксидов и кислорода. Например, реакция кислорода с железом дает оксид железа:
- 4Fe + 3O2 ⟶ 2Fe2O3
Оксид железа может реагировать с водой:
- Fe2O3 + 3H2O ⟶ 2Fe(OH)3
Таким образом, в результате реакции вода и оксид железа образуют гидроксид железа (растворимый осадок).
| Металл | Оксид | Реакция с водой |
|---|---|---|
| Натрий | Na2O | Na2O + H2O ⟶ 2NaOH |
| Железо | Fe2O3 | Fe2O3 + 3H2O ⟶ 2Fe(OH)3 |
| Медь | CuO | CuO + H2O ⟶ Cu(OH)2 |
Основные принципы реакций
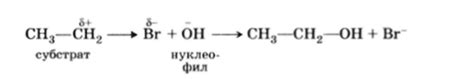
Взаимодействие воды с оксидами металлов основано на следующих принципах:
- Образование кислоты или основы. При контакте оксида металла с водой происходит реакция, в результате которой может образоваться кислота или основание. Кислота возникает, если оксид металла обладает кислотными свойствами и способен отдавать протоны, а основание образуется, если оксид металла обладает щелочными свойствами и способен принимать протоны.
- Образование соли. Реакция между водой и оксидом металла может привести к образованию соли, если оба компонента обладают соответствующими свойствами. В этом случае, ионы металла из оксида образуют соль, а ионы воды (гидроксидные и оксоанионные) образуют кислотный или основной остаток.
- Образование открытых и закрытых гидратов. Вода может образовать с оксидами металлов растворимые гидраты – соединения, в которых молекулы воды окружают катион металла. В зависимости от условий, гидраты могут быть открытыми или закрытыми, что влияет на свойства и структуру образовавшихся соединений.
- Изменение оксидации металла. В реакции с водой оксид металла может изменить свою степень окисления. Например, некоторые металлы окисляются и вступают в реакцию, образуя оксиды с более высокой степенью окисления.
Таким образом, изучение взаимодействия воды с оксидами металлов позволяет понять основные принципы этих реакций и применить полученные знания в химических процессах и технологиях.
Взаимодействие с щелочными оксидами

Щелочные оксиды образуются при взаимодействии кислорода с щелочными металлами. Они характеризуются высокой активностью и способностью реагировать с водой, образуя основания. Реакция щелочных оксидов с водой называется гидратацией.
Во время гидратации щелочные оксиды превращаются в гидроксиды, при этом выделяется большое количество тепла. Например, гидратация оксида натрия (Na2O) приводит к образованию гидроксида натрия (NaOH). Реакция протекает очень быстро и сопровождается плавлением гидроксида.
Уравнение гидратации оксида натрия представляет собой:
| Na2O + H2O → | 2NaOH + ΔH |
Энергия, выделяющаяся при гидратации щелочных оксидов, обеспечивает большую реакционную способность этих соединений. Они обладают амфотерными свойствами и способны реагировать как с кислотами, так и с основаниями.
Взаимодействие щелочных оксидов с водой используется в ряде технических и промышленных процессов. Например, гидратация оксида калия (K2O) применяется для получения гидроксида калия (KOH) - важного реактива в химической промышленности. Также гидроксиды щелочных металлов широко используются в процессах очистки воды и в производстве моющих и моюще-очистительных средств.
Взаимодействие с кислотными оксидами

Кислотные оксиды представляют собой соединения металлов с кислородом, которые обладают кислотными свойствами. При взаимодействии с водой кислотные оксиды образуют кислоты.
Процесс взаимодействия кислотных оксидов с водой называется гидратацией. В результате гидратации оксиды металлов растворяются в воде, образуя кислоты.
Водородные оксиды металлов, такие как оксид алюминия (Al2O3), оксид железа (Fe2O3) и оксид цинка (ZnO), реагируют с водой, образуя кислоты и выделяя водород. Например, оксид алюминия взаимодействует с водой с образованием алюминия гидроксида (Al(OH)3) и выделением водорода.
Кроме того, при гидратации кислотных оксидов часто образуются не только кислоты, но и отличающиеся от них соединения. Например, оксид серы (SO2) взаимодействует с водой, образуя сульфиты (Na2SO3) или сульфаты (Na2SO4) в зависимости от условий реакции.
Взаимодействие с амфотерными оксидами

Амфотерными оксидами называются оксиды металлов, которые могут проявлять свойства и кислот, и оснований. Такие оксиды обладают способностью взаимодействовать как с кислотами, так и с основаниями, в зависимости от условий реакции и реагентов, участвующих в процессе.
Вода является одним из наиболее распространенных реагентов для взаимодействия с амфотерными оксидами. При растворении амфотерного оксида в воде происходит образование гидроксида металла и образование ионов водорода или гидроксид-иона в зависимости от реактивности металла.
Например, оксид алюминия (Al2O3) является амфотерным оксидом. При реакции оксида алюминия с водой образуется гидроксид алюминия (Al(OH)3), который, в свою очередь, может вступать в реакцию с кислотами или основаниями.
Амфотерные оксиды имеют важное прикладное значение в различных областях. Например, гидроксид алюминия используется в производстве лекарственных препаратов, катионитов для очистки воды и других промышленных процессов. Эти оксиды также разносторонне применяются в химической промышленности и технологии.
Вопрос-ответ

Каким образом происходит взаимодействие воды с оксидами металлов?
Взаимодействие воды с оксидами металлов происходит при образовании кислот или щелочей. В случае оксида некоторых металлов, таких как натрий или калий, образуется щелочное растворимое гидроксидное соединение. А в случае оксида металлов с переменной валентностью (таких как железо или медь), образуется кислотное растворимое гидроксидное соединение.
Какие принципы лежат в основе взаимодействия воды с оксидами металлов?
Основными принципами взаимодействия воды с оксидами металлов являются образование гидроксидов металлов и реакции кислотности. Если оксид металла содержит металл с ярко выраженными основными свойствами (например, щелочной металл), то происходит образование щелочного гидроксида. Если же оксид металла содержит металл с выраженными кислотными свойствами (например, железо), то образуется кислотный гидроксид.
Какие реакции могут происходить при взаимодействии воды с оксидами металлов?
При взаимодействии воды с оксидами металлов могут происходить различные реакции, в зависимости от характера оксида и его металла. Например, при взаимодействии оксида натрия или калия с водой образуется щелочной раствор. А при взаимодействии оксида железа с водой образуется кислотный раствор. Также могут происходить реакции окисления и восстановления.
Какие соединения образуются при взаимодействии воды с оксидами металлов?
При взаимодействии воды с оксидами металлов образуются соединения, которые могут быть как растворимыми в воде, так и нерастворимыми. Например, при взаимодействии оксида натрия или калия с водой образуются растворимые в воде щелочные гидроксиды. А при взаимодействии оксида железа с водой образуется кислотный гидроксид, который также растворим в воде. Однако, есть и оксиды металлов, которые образуют нерастворимые соединения с водой и остаются в виде осадка.
