Вода — одно из наиболее распространенных веществ на Земле. Ее молекула состоит из двух атомов водорода и одного атома кислорода и обладает особыми химическими свойствами. Она является не только необходимой для существования жизни, но и играет важную роль во многих химических реакциях. Одной из таких реакций является реакция воды с оксидами металлов.
Оксиды металлов — это химические соединения, состоящие из атомов металла и кислорода. Они могут быть как щелочными, так и кислотными, в зависимости от свойств содержащегося в них металла. При взаимодействии оксидов металлов с водой происходят различные химические реакции, в результате которых образуются кислоты или основания, а также осадки в виде оксидов.
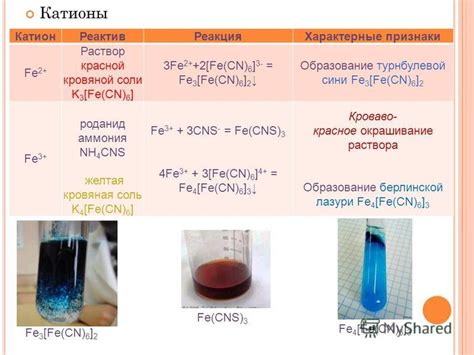
Если оксид металла растворяется в воде, то образуется кислота. Например, оксид серы (IV) (SO2) реагирует с водой, образуя серную кислоту (H2SO4). Также оксид азота (V) (NO2) взаимодействует с водой, образуя азотную кислоту (HNO3). Реакция оксида металла с водой представляет собой высвобождение ионов металла и ионов водорода, что приводит к образованию кислоты.
С другой стороны, некоторые оксиды металлов образуют основания при реакции с водой. Например, оксид натрия (Na2O) реагирует с водой, образуя гидроксид натрия (NaOH). Также оксид кальция (CaO) взаимодействует с водой, образуя гидроксид кальция (Ca(OH)2). Эти реакции приводят к образованию основания, которое может использоваться в различных химических процессах и промышленности.
Реакция воды с оксидами металлов играет важную роль в химии и промышленности. Она позволяет получать кислоты и основания, которые используются в различных химических процессах. Также реакция приводит к образованию осадков в виде оксидов металлов, которые имеют широкое применение в различных отраслях промышленности.
Оксиды металлов и их свойства
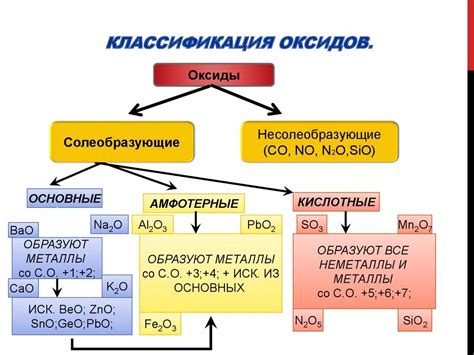
Оксиды металлов - это химические соединения, состоящие из кислорода и металла. Они являются основными компонентами природных минералов и широко применяются в промышленности и научных исследованиях. Оксиды металлов обычно обладают хорошей стабильностью и высокой температурой плавления и часто встречаются в виде кристаллических соединений.
Свойства оксидов металлов могут сильно различаться в зависимости от типа металла и степени окисления. Некоторые оксиды обладают кислотными свойствами и реагируют с водой, образуя кислоты. Другие оксиды действуют как основания и реагируют с водой, образуя гидроксиды металлов. Еще один тип оксидов металлов - амфотерные, они могут реагировать как с кислотами, так и с основаниями.
Также оксиды металлов могут обладать различными физическими свойствами, такими как цвет, твердость и проводимость электричества. Многие оксиды металлов являются нелистопроводящими и имеют высокую температуру плавления, что делает их полезными материалами для изготовления керамики и стекла. За счет своего цвета некоторые оксиды металлов находят применение в производстве красителей и пигментов.
Оксиды металлов также широко используются в катализаторах, керамической промышленности, электронике и других областях. Они имеют важное значение в химическом производстве и научных исследованиях. Многие из них обладают высокой термической стабильностью и стабильностью по отношению к окружающей среде, что делает их незаменимыми материалами для различных технических приложений.
В заключение, оксиды металлов являются важными химическими соединениями, которые имеют разнообразные свойства и применение в различных отраслях промышленности и науки. Они обладают как кислотными, так и основными свойствами, а также обладают различными физическими характеристиками, которые делают их полезными и востребованными материалами. Изучение оксидов металлов играет важную роль в области химии и материаловедения.
Реакция оксидов металлов с водой
Оксиды металлов, как правило, обладают высокой химической активностью и могут реагировать с водой. В результате такой реакции образуются кислоты, основания или другие оксиды.
В случае реакции оксида металла с водой, происходит образование соответствующей основы. Это происходит потому, что оксид металла взаимодействует с водой и образует гидроксид металла. Гидроксид также может быть назван основанием, так как он способен принимать протоны и образовывать соли.
Однако, не все оксиды металлов реагируют с водой. Некоторые оксиды, такие как оксид железа (III), не растворяются в воде и не взаимодействуют с ней. В то же время, некоторые оксиды металлов, такие как оксид натрия, сильно растворимы в воде и образуют щелочные растворы, которые являются основаниями.
Также существуют оксиды металлов, которые реагируют с водой и образуют кислоты. Это происходит, когда оксид металла растворяется в воде и образует кислоту. Примером такой реакции может служить реакция оксида серы с водой, при которой образуется серная кислота.
В общем случае, реакция оксидов металлов с водой зависит от химических свойств самого оксида и может приводить к образованию кислот, оснований или других оксидов в зависимости от условий и стехиометрии реакции.
Образование кислот при реакции с водой
Реакция многих оксидов металлов с водой приводит к образованию кислот. В результате этой реакции оксид металла переходит в растворимую соль кислоты.
Процесс образования кислоты при реакции с водой может быть проиллюстрирован на примере сернистого газа (SO2), который образует серную кислоту (H2SO4). Сначала SO2 реагирует с водой, превращаясь в образовавшуюся сернокислую соль:
- SO2 + H2O -> H2SO3
Далее сернистая кислота (H2SO3) может претерпеть протолиз, то есть реагировать с водой, образуя ион гидрооксония и обратно превращаясь в оксид металла и воду:
- H2SO3 + H2O -> H3O+ + HSO3-
- HSO3- -> H+ + SO3^2-
Таким образом, при реакции сернистого газа с водой образуется серная кислота (H2SO4), которая может быть использована в различных производственных процессах или быть добавлена в качестве реагента при химических реакциях.
Свойства и применение образовавшихся кислот
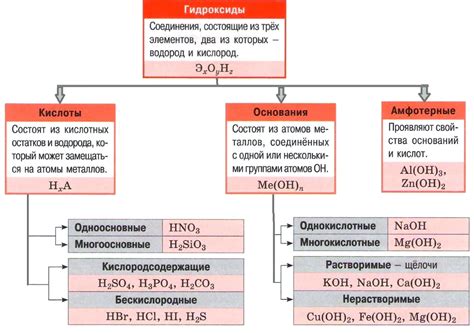
В результате реакции воды с оксидами металлов образуются различные кислоты. Эти кислоты обладают рядом свойств, которые делают их полезными в различных областях.
1. Кислоты являются растворимыми в воде, что позволяет эффективно использовать их в химической промышленности и лабораторных исследованиях. Благодаря своей растворимости, кислоты легко смешиваются с другими веществами, что позволяет получать различные соединения и реакции.
2. Кислоты обладают кислотными свойствами: они реагируют с основаниями, образуя соль и воду. Это позволяет использовать кислоты для регулирования кислотно-щелочного баланса в различных областях, включая медицину, пищевую промышленность и производство моющих средств.
3. Кислоты обладают коррозионными свойствами: они способны разрушать определенные материалы, особенно металлы. В силу этого, кислоты используются для удаления окислов и ржавчины с металлических поверхностей, а также для очистки и обработки различных материалов.
4. Кислоты используются в аналитической химии: они являются важным инструментом при определении и измерении концентрации различных веществ. Анализ кислотности среды является одним из основных методов химического анализа и позволяет оценить качество и состояние вещества.
5. Кислоты применяются в промышленности для синтеза других химических соединений: они служат исходным материалом для получения различных продуктов, включая пластик, удобрения, лекарственные препараты и многое другое.
Таким образом, образующиеся в результате реакции воды с оксидами металлов кислоты обладают разнообразными свойствами и широко применяются в различных областях человеческой деятельности.
Образование оснований при реакции с водой
Реакция металлических оксидов с водой приводит к образованию оснований — неорганических соединений, которые обладают свойствами оснований, то есть способностью принимать протоны от воды или других кислот. Образование оснований происходит при взаимодействии оксидов металлов с водой, где оксид реагирует с водой и образует гидроксид металла и тепловую энергию.
С ростом активности металла его оксиды реагируют с водой все более интенсивно. Например, оксид натрия малоактивен при комнатной температуре и образует гидроксид натрия (NaOH) очень медленно. Однако, оксид калия активнее оксида натрия и образует гидроксид калия (KOH) при взаимодействии с водой более быстро.
Образование оснований при реакции с водой является важным процессом в химической промышленности, поскольку гидроксиды металлов находят широкое применение в различных отраслях. Например, гидроксид натрия используется в производстве мыла, стекла и бумаги, а гидроксид калия — в косметической и фармацевтической промышленности.
Свойства и применение образовавшихся оснований
Образовавшиеся основания в результате реакции воды с оксидами металлов обладают рядом свойств, которые делают их полезными в различных областях жизни.
Во-первых, основания обладают щелочными свойствами, что означает, что они способны нейтрализовать кислоты. В результате реакции между кислотой и основанием образуется соль и вода. Это свойство оснований позволяет использовать их в медицине для лечения изжоги и других образований, вызванных избытком кислоты в желудке.
Во-вторых, основания способны образовывать растворы, которые обладают щелочной реакцией. Это позволяет использовать их в различных химических процессах, например, при очистке отходов и сточных вод. Основания могут нейтрализовать кислые субстанции, тем самым улучшая качество воды и делая ее безопасной для использования.
Кроме того, основания могут использоваться в производстве моющих средств и косметических продуктов. Они способны растворять жировые отложения и загрязнения, делая поверхность чистой и гладкой. Благодаря этому свойству основания находят широкое применение в бытовых средствах для мытья посуды, стиральных порошках и других средствах гигиены.
Значение реакции воды с оксидами металлов в природе и промышленности

Реакция воды с оксидами металлов играет важную роль в природе и промышленности. Эта химическая реакция приводит к образованию кислот, оснований и оксидов, которые влияют на окружающую среду и применяются в различных отраслях промышленности.
В природе реакция воды с оксидами металлов способствует образованию карстовых явлений. При контакте воды с оксидами металлов, например с оксидом железа, образуется раствор, содержащий железные ионы. Такой раствор попадает в грунтовые воды и может вызывать изменение pH воды, что приводит к разрушению минералов и образованию пустот и каверн. Это явление называется карстом и может приводить к обвалам земли и опасности для жизни.
В промышленности реакция воды с оксидами металлов используется для производства кислот и оснований. Например, реакция воды с оксидом серы приводит к образованию серной кислоты, которая широко используется в промышленности для производства удобрений, пластмасс, текстиля и других продуктов. А реакция воды с оксидом кальция приводит к образованию гидроксида кальция, или известкового щелока, который используется в строительстве, производстве стекла и в других отраслях промышленности.
Также, в результате реакции воды с оксидами металлов образуются оксиды, которые могут служить катализаторами, абсорбентами или носителями активных веществ. Например, оксид алюминия используется в качестве катализатора при производстве пластмасс и веществ, а оксид железа может использоваться в виде красителя или в качестве сырья для производства стали.
Таким образом, реакция воды с оксидами металлов имеет большое значение как в природе, так и в промышленности, позволяя получать кислоты, основания и оксиды, которые находят применение в различных сферах жизни и производства.
Вопрос-ответ

Какие оксиды металлов реагируют с водой?
С некоторыми металлами реакция с водой протекает с выделением газа. Например, щелочные металлы (натрий, калий) и магний образуют соответствующие щелочи. Они образуют кислоты, которые можно получить только из минеральных кислот.
Как образуется основание при реакции воды с оксидами металлов?
При реакции воды с оксидами металлов происходит образование соответствующего гидроксида металла, который является основанием. Например, оксид натрия реагирует с водой и образует гидроксид натрия (щелочь).
Какие кислоты образуются при реакции воды с оксидами металлов?
При реакции воды с оксидами металлов образуются соответствующие кислоты. Например, оксид серы реагирует с водой и образует серную кислоту, оксид азота реагирует с водой и образует азотную кислоту. Также существуют смешанные кислоты, например, соляная кислота (получаемая из оксида хлора и воды).
Каков механизм реакции воды с оксидами металлов?
Механизм реакции воды с оксидами металлов может быть описан следующим образом: оксид металла взаимодействует с водой, образуя гидроксид металла и соответствующую кислоту. Образовавшаяся кислота может либо оставаться в растворе, либо отделяться в виде осадка. В случае со щелочными металлами образовывается щелочь, которая является гидроксидом металла и придаёт раствору щелочную реакцию.
Какие свойства имеют образовавшиеся кислоты при реакции воды с оксидами металлов?
Образовавшиеся кислоты при реакции воды с оксидами металлов имеют различные свойства в зависимости от металла и оксида. Например, серная кислота является сильной кислотой, а азотная кислота является слабой кислотой. Некоторые кислоты могут быть амфотерными, то есть иметь как кислотные, так и основные свойства.
