Металлы группы — это элементы, которые расположены в одной группе периодической таблицы. Они имеют общую химическую природу и сходные свойства. В частности, многие из них обладают способностью реагировать с водой при нагревании.
Одной из наиболее хорошо известных реакций является реакция алюминия с водой. При нагревании алюминий начинает реагировать с кислородом из воды, образуя оксид алюминия и выделяя водород. Эта реакция является примером окислительного восстановления, где алюминий окисляется, а кислород восстанавливается.
Также хорошо известна реакция магния с водой. При нагревании магний выделяет водород и образует гидроксид магния. Эта реакция также является окислительным восстановлением, где магний окисляется, а кислород восстанавливается.
Вода также может реагировать с цинком. При нагревании цинк выделяет водород и образует гидроксид цинка. Эта реакция также относится к группе окислительного восстановления, где цинк окисляется, а кислород восстанавливается.
В результате реакции металлов группы с водой при нагревании образуется гидроксид металла и выделяется водород. Эти реакции прекрасно иллюстрируют основные свойства металлов группы, такие как их способность к окислению и восстановлению. Таким образом, изучение реакций металлов с водой при нагревании имеет важное значение для понимания их химической активности и использования в различных промышленных процессах.
Реакции металлов группы с водой при нагревании

Металлы группы, такие как литий, натрий, калий, рубидий и цезий, проявляют активную реакцию с водой, особенно при нагревании. При этом образуется соответствующий гидроксид металла и выделяется водородный газ.
Например, литий при нагревании с водой образует гидроксид лития (LiOH), который является щелочным раствором. При этом водородный газ выделяется в виде пузырьков.
Аналогичные реакции происходят и с другими металлами группы. Натрий при нагревании с водой образует гидроксид натрия (NaOH), калий - гидроксид калия (KOH) и так далее.
При проведении этих реакций следует быть осторожным, так как они протекают с выделением большого количества тепла и газа. Возможны вспышки и взрывы, поэтому реакцию лучше проводить в специальной аппаратуре или под контролем опытного химика.
Таким образом, реакции металлов группы с водой при нагревании проявляются в образовании соответствующего гидроксида и выделении водорода. Эти реакции часто используются в лабораторных исследованиях и промышленности для получения гидроксидов металлов и водорода.
Металлы первой группы

Металлы первой группы периодической системы включают литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они обладают характерными свойствами, среди которых высокая реакционность при контакте с водой.
В реакции металлы первой группы образуют гидроксиды и высвобождаются водород. Реактивность металлов возрастает в направлении сверху вниз по группе. Например, литий реагирует с водой медленнее, чем рубидий. При контакте с водой металлы первой группы образуют щелочные растворы гидроксидов - легко растворимых в воде сильных оснований.
Реакция металлов первой группы с водой происходит следующим образом: металл растворяется в воде, образуя гидроксид металла и выделяя водород. Образовавшийся гидроксид может реагировать с кислородом из воздуха, образуя карбонат металла.
- Литий реагирует с водой медленно, выделяя малое количество водорода. Полученный гидроксид лития образует карбонат при взаимодействии с углекислым газом.
- Натрий реагирует с водой более активно, выделяя значительное количество водорода. Гидроксид натрия растворяется в воде, образуя щелочной раствор.
- Калий реагирует с водой еще активнее, выделяя больше водорода. Гидроксид калия также образует щелочной раствор.
Эти металлы первой группы широко используются в различных областях, включая производство щелочных растворов и водородных генераторов.
Металлы второй группы
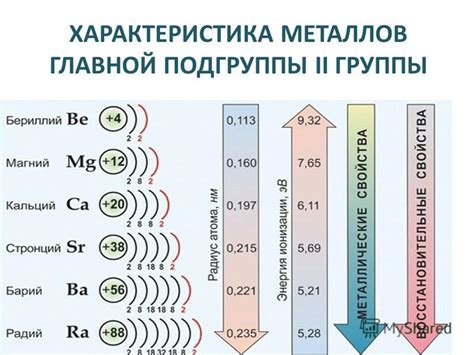
Металлы второй группы включают в себя кальций (Ca), стронций (Sr) и барий (Ba). Они все реагируют с водой, образуя соответствующие гидроксиды и выделяя водородный газ.
Начнем с кальция. При контакте с водой кальций выделяет водородный газ и образует гидроксид кальция (Ca(OH)2). Эта реакция является очень быстрой и сопровождается образованием белого осадка.
Стронций также реагирует с водой, но намного медленнее, по сравнению с кальцием. Он образует гидроксид стронция (Sr(OH)2) и выделяет водород.
Барий, в свою очередь, также реагирует с водой, образуя гидроксид бария (Ba(OH)2) и выделяя водород. Реакция бария с водой происходит очень медленно.
Стоит отметить, что все металлы второй группы имеют более высокую активность, чем металлы первой группы. Это связано с тем, что атомы этих металлов имеют меньшую электронную оболочку и тем самым легче отдавать электроны в реакции с водой.
Вопрос-ответ

Какие металлы группы могут реагировать с водой при нагревании?
В группе металлов группы реактивность растет снизу вверх: натрий, калий, рубидий и цезий. Эти металлы реагируют с водой при нагревании и выделяются водородный газ.
Чему равна общая реакция металлов группы с водой при нагревании?
Общая реакция для металлов группы с водой при нагревании может быть записана следующим образом: 2M + 2H2O -> 2MOH + H2, где M - металл.
Почему металлы группы реагируют с водой при нагревании?
Металлы группы реагируют с водой при нагревании из-за их химической активности. Они имеют низкую ионизационную энергию и легко отдают электроны, что позволяет им реагировать с водой и образовывать гидроксиды металлов и водородный газ.
Какие свойства металлов группы проявляются при их реакции с водой?
При реакции с водой металлы группы образуют гидроксиды и выделяются водородный газ. Также в процессе реакции проявляются химические свойства металлов, такие как активность, способность отдавать электроны и образовывать положительные ионы.
Какие факторы могут влиять на скорость реакции металлов группы с водой при нагревании?
На скорость реакции металлов группы с водой при нагревании могут влиять такие факторы, как размер металла, его химическая активность, температура воды и концентрация раствора.
