Соли кислот металлов - это химические соединения, состоящие из катиона металла и аниона кислоты. Взаимодействие солей кислот металлов обладает рядом особенностей, с которыми необходимо ознакомиться для понимания и изучения данного процесса.
В первую очередь, стоит отметить, что реакция взаимодействия солей кислот металлов может быть как экзотермической, то есть сопровождаться выделением тепла, так и эндотермической, когда поглощается тепло. Это зависит от конкретного соединения и условий реакции.
Второй особенностью взаимодействия солей кислот металлов является возможность образования осадка. При смешении растворов солей кислот металлов могут образовываться не только новые химические соединения, но и нерастворимые вещества - осадок. Это может служить основой для различных методов синтеза или анализа в химии.
Также, важно отметить, что свойства солей кислот металлов могут существенно различаться в зависимости от ионного радиуса и заряда металла, аниона кислоты, а также условий окружающей среды, в которой проходит реакция. Это позволяет добиться широкого спектра реакций и применения солей кислот металлов в различных сферах науки и технологий.
Роль солей в химических реакциях
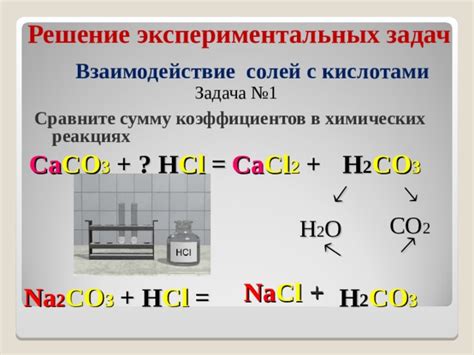
Соли – это химические соединения, состоящие из катиона металла и аниона кислоты. Их роль в химических реакциях является важной и многообразной. Соли используются как катализаторы реакций, а также участвуют в образовании новых соединений.
Прежде всего, соли играют роль катализаторов реакций. Они ускоряют химические превращения, оказывая влияние на скорость реакций без изменения своей структуры. Соли при этом не расходуются и могут использоваться в нескольких циклических процессах.
Кроме того, соли участвуют в образовании новых соединений. Они могут реагировать с другими веществами и преобразовываться в более сложные соединения. Например, при взаимодействии соляной кислоты и магния образуется хлорид магния. Такие химические реакции позволяют получать необходимые вещества и применять их в различных областях науки и техники.
Также стоит отметить, что некоторые соли обладают специфическими свойствами и могут быть использованы в качестве индикаторов реакций. Например, перманганат калия является индикатором окислительно-восстановительных реакций, а барретсова соль используется для определения двухвалентной железа.
Факторы, влияющие на взаимодействие солей кислот металлов

Взаимодействие солей кислот металлов зависит от различных факторов, которые влияют на характер и скорость реакции. Эти факторы играют важную роль в образовании соединений и определяют условия и способы проведения химических превращений.
Один из главных факторов – концентрация реагентов. Чем выше концентрация солей кислот металлов, тем больше возможности для их взаимодействия с другими веществами. Концентрация влияет на скорость реакции: чем выше концентрация, тем быстрее протекает процесс образования новых соединений.
Температура является также важным фактором, влияющим на взаимодействие солей кислот металлов. При повышении температуры молекулярная активность возрастает, что способствует ускорению химических реакций. Высокая температура может также изменить способность кислотных металлов образовывать ионы и взаимодействовать с другими соединениями.
Размер молекул также играет роль в химических реакциях. Малые молекулы могут легче проникнуть в структуру других соединений и взаимодействовать с ними, в то время как более крупные молекулы могут оказывать сопротивление или потребовать дополнительных условий для взаимодействия.
Другим важным фактором является pH среды. Различные соли кислот металлов могут образовывать щелочные или кислые растворы, что может существенно влиять на их взаимодействие с другими соединениями. pH среды может меняться в зависимости от концентрации реагентов и условий проведения реакции.
Таким образом, факторы, влияющие на взаимодействие солей кислот металлов, включают концентрацию реагентов, температуру, размер молекул и pH среды. Понимание этих факторов позволяет проводить химические реакции более эффективно и контролировать характер и скорость образования новых соединений.
Типичные реакции солей кислот металлов

Соли кислот металлов являются соединениями, получаемыми в результате реакции металлов с кислотами. Они обладают специфическими свойствами и способны проявлять различные реакции при взаимодействии с другими веществами.
Одной из типичных реакций солей кислот металлов является растворение в воде. При этой реакции ионы металла и ионы кислоты разделяются и образуют раствор, который может проявлять определенные свойства. Например, растворы солей железа могут окрашиваться в различные оттенки, в зависимости от окислительного состояния металла.
Еще одной типичной реакцией солей кислот металлов является образование осадков при смешении растворов двух солей. При этом образуются новые соединения, которые выпадают в осадок. Примером такой реакции может служить смешение растворов соли железа(II) и соли калия гексацианоферрата(III), в результате которого образуется синий осадок гексацианоферрата железа(II).
Также, соли кислот металлов могут образовывать комплексные соединения с различными лигандами. Это специфические соединения, которые формируются при взаимодействии ионов металла и лигандов. Например, соль железа(III) может образовывать комплекс с лигандом цианидом, образуя соединение, известное как цианид содержит определенную связь с металлом и проявляет специфические свойства.
Таким образом, соли кислот металлов проявляют различные реакции при взаимодействии с другими веществами. Растворение в воде, образование осадков и формирование комплексных соединений являются типичными реакциями солей кислот металлов, которые имеют свои специфические особенности и могут быть использованы в химических процессах и технологиях.
Образование новых соединений при взаимодействии солей металлов и кислот

Взаимодействие солей металлов и кислот приводит к образованию новых соединений – солей. Соли являются химическими соединениями, состоящими из катионов и анионов. При этом катионы образуются от металлов, а анионы – от кислот.
Образование солей происходит посредством ионной реакции, при которой происходит обмен ионами между солью и кислотой. В результате этой реакции катионы и анионы образуют новые связи, образуя твердое вещество – соль.
Взаимодействие солей металлов и кислот может протекать по разным сценариям в зависимости от химических свойств ионов. Например, при взаимодействии нитратов металлов и соляной кислоты образуется хлорид металла и азотная кислота. А при взаимодействии сульфатов металлов и серной кислоты возникают сульфат металла и вода.
Важно отметить, что образование новых соединений при взаимодействии солей металлов и кислот имеет практическую значимость. Например, соли металлов широко применяются в промышленности, медицине, сельском хозяйстве и других отраслях. Взаимодействие солей и кислот также может использоваться для синтеза различных органических соединений и исследования их свойств.
Изменение свойств солей при взаимодействии с кислотами

Когда соли кислот металлов взаимодействуют с кислотами, происходят различные химические реакции, в результате которых свойства солей могут изменяться.
Первым и наиболее распространенным видом реакции является образование новой соли и освобождение воды. В данном случае ионы кислоты и ионы соли обмениваются местами, что приводит к образованию новой соли и освобождению молекул воды. Например, при соединении хлорида натрия (NaCl) и серной кислоты (H2SO4) образуется сульфат натрия (Na2SO4) и образуется вода. Такая реакция называется нейтрализацией.
Вторым типом реакции при взаимодействии солей с кислотами является окислительно-восстановительная реакция. В данном случае ионы металла в соли изменяют свою степень окисления. Например, при взаимодействии хлорида железа (FeCl3) с серной кислотой (H2SO4) образуются сульфат железа (Fe2(SO4)3) и хлорид водорода (HCl). Одновременно ионы железа в соли претерпевают окисление, а ионы серы в кислоте - восстановление. Такие реакции являются более сложными и могут протекать только в определенных условиях.
Также соли могут образовывать комплексные соединения с кислотами, в результате которых образуются новые соединения с измененными свойствами. Комплексные соединения характеризуются наличием в своей структуре центрального атома, к которому координатно связаны атомы кислорода или других элементов. Например, хлорид железа (FeCl3) может образовывать комплексное соединение с соляной кислотой (HCl), при этом образуется хлорид железа соляной кислоты (FeCl4H) с измененными свойствами.
Практическое применение взаимодействия солей кислот металлов
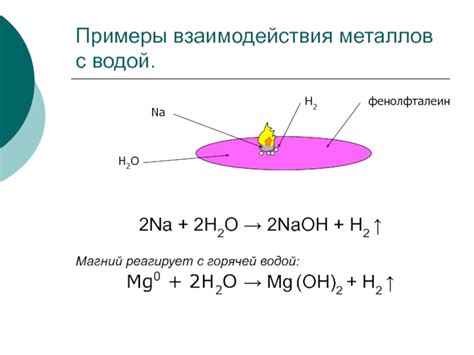
Процессы взаимодействия солей кислот металлов широко применяются в различных областях науки и техники.
Одним из основных направлений их практического использования является химический анализ и определение металлов. Взаимодействие солей кислот металлов позволяет осуществлять качественный и количественный анализ различных проб. Например, для определения содержания железа, реактив добавляют, чтобы соли кислоты железа окислились и образовались видимые окрашенные соединения. Это позволяет точно определить концентрацию железа в исследуемом образце.
Взаимодействие солей кислот металлов находит применение в технологических процессах производства металлических изделий. Например, при гальваническом покрытии металлов, соли кислот металлов используются в составе электролита. Процесс осаждения слоя металла на поверхности изделия осуществляется благодаря взаимодействию солей кислоты металла с электрическим током.
Взаимодействие солей кислот металлов применяется также в области медицины и фармацевтики. Некоторые соединения, полученные в результате этого взаимодействия, могут обладать лекарственными свойствами или использоваться в качестве компонентов лекарственных препаратов. Например, соли кислоты серебра имеют антимикробные свойства и широко используются в медицине для обработки ран и раневых поверхностей.
Кроме того, взаимодействие солей кислот металлов применяется в процессах очистки воды. Некоторые соли кислоты металла обладают свойством осаждаются с водой, удаляя тяжелые металлы и другие загрязнения из водных растворов. Этот процесс, называемый коагуляцией, позволяет очистить воду от опасных примесей и сделать ее безопасной для использования в бытовых и технологических целях.
Вопрос-ответ

Какие реакции могут происходить при взаимодействии солей кислот металлов?
При взаимодействии солей кислот металлов могут происходить различные реакции, в том числе осаждение нерастворимых оснований или гидроксидов металлов, осаждение металлов в виде металлических отложений, образование новых солей с другими кислотами и превращение солей металлов в кислоты.
Какие особенности характерны для взаимодействия солей кислот металлов?
Одной из особенностей взаимодействия солей кислот металлов является возможность осаждения нерастворимых оснований или гидроксидов металлов. Также в ходе реакции может происходить образование металлических отложений, осадки новых солей и превращение солей металлов в кислоты. Взаимодействие солей кислот металлов обычно сопровождается появлением особых цветовых эффектов, что дает возможность использовать эти реакции для определения наличия или количественного определения металлов.
Какова основная цель взаимодействия солей кислот металлов?
Основная цель взаимодействия солей кислот металлов заключается в получении определенного продукта реакции. Например, при взаимодействии солей кислот металлов может формироваться нерастворимое основание или гидроксид металла, который может использоваться в различных областях, например, в производстве косметических препаратов или катализаторов. Также взаимодействие солей кислот металлов может использоваться для определения наличия или количественного определения металлов.
