Взаимодействие солей с металлами – один из важных процессов в химии, который позволяет получать различные соединения и материалы. Однако, для того чтобы реакция произошла, необходимо выполнение определенного условия.
Главным условием реакции является наличие свободного металла, готового вступить в химическую связь. Соли представляют собой соединения, в которых металл замещает положительный ион, а отрицательная часть соединения образуется из отрицательного иона. Именно взаимодействие положительно и отрицательно заряженных частей приводит к образованию новых соединений.
Однако, не все металлы способны взаимодействовать с солями. Для этого металл должен обладать достаточной активностью, то есть иметь способность активно вступать в реакции. Активность металла зависит от его электрохимического потенциала. Металлы с более низким потенциалом активнее металлы с более высоким потенциалом, поэтому они могут вытеснять их из соединений, что приводит к реакции.
Таким образом, для того чтобы произошло взаимодействие солей с металлами, необходимо наличие свободного металла с достаточной активностью. При этом реакция протекает в соответствии с законом сохранения массы и заряда, что позволяет получить новые соединения и открывает широкие возможности для использования данного процесса в химической промышленности и различных научных исследованиях.
Реакция солей с металлами: ключевые моменты
Взаимодействие солей с металлами является одним из важных процессов, которые происходят в химических реакциях. Для того чтобы такая реакция произошла, необходимо выполнение определенного условия. Это условие - наличие активного металла, который может образовывать соединение с теми ионами, которые присутствуют в растворе соли.
Активные металлы обладают высокой химической активностью и легко взаимодействуют с другими веществами. Они часто находятся в левой части периодической таблицы и образуют положительные ионы. Примерами активных металлов являются натрий, калий, алюминий и многие другие.
В реакции солей с металлами ионы металла, находясь в растворе соли, замещают ионы другого металла и образуют с ним соединение. Например, если в растворе содержится соль меди, то активный металл, такой как цинк, может реагировать с этой солью и замещать ион меди. При этом образуется новое вещество - цинковая соль, а ион меди выпадает в осадок.
При проведении реакции солей с металлами необходимо обратить внимание на различные факторы, которые могут влиять на скорость и характер реакции. Один из таких факторов - концентрация реагентов. Чем выше концентрация соли и металла в реакционной смеси, тем быстрее будет протекать реакция. Кроме того, температура также может оказывать влияние на реакцию, при повышении температуры процесс может протекать более быстро.
Таким образом, реакция солей с металлами является важным процессом, который требует определенных условий для своего протекания. Активные металлы, концентрация реагентов и температура - это ключевые моменты, на которые следует обратить внимание при изучении этой химической реакции.
Понятие реакции солей с металлами

Реакция солей с металлами – это процесс взаимодействия химических соединений, называемых солями, с металлами. Соли представляют собой химические соединения, состоящие из положительно и отрицательно заряженных ионов. Металлы, в свою очередь, являются химическими элементами, обладающими хорошей электропроводностью и благодаря своим свойствам широко используемы в различных областях науки и промышленности.
Ослабляющим фактором для реакции солей с металлами является стабильность химических связей между ионами в соли. Если связи в соли сильны и стабильны, то реакция с металлами будет проходить слабо или вообще не будет возможна. В таком случае необходимы специальные условия или реагенты, которые могут активировать взаимодействие соли с металлами.
Однако, если связи между ионами в соли слабы и нестабильны, то реакция с металлами может происходить легко и с выделением значительного количества энергии. Такие реакции часто сопровождаются процессами окисления и восстановления, в результате которых металлы могут менять свою степень окисления и образовывать новые химические соединения.
Реакция солей с металлами может быть различного вида и проявляться в образовании осадка, выделении газов или изменении цвета раствора. Важным фактором для успешного взаимодействия солей с металлами является также подбор подходящих растворов и условий окружающей среды, которые могут способствовать активации реакции.
Взаимодействие солей с металлами: главное условие

Главным условием для взаимодействия солей с металлами является наличие электрической связи между ионами металла и ионами из соли. Это означает, что металл должен быть способен отдавать или принимать электроны, а ионы соли должны быть способны принимать или отдавать электроны.
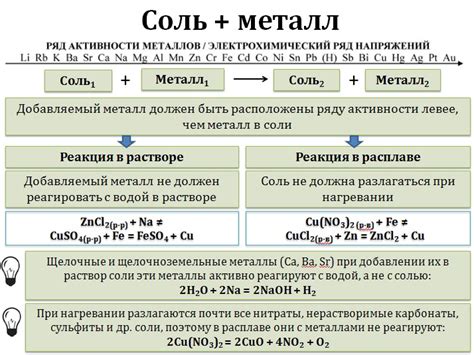
Взаимодействие металлов с солями может происходить по двум основным сценариям. Первый сценарий – это реакция металла с раствором соли, когда металл вытесняет ион металла из раствора, образуя твердый осадок. Например, железо может вытеснить медь из раствора сульфата меди:
Fe + CuSO4 → FeSO4 + Cu
Второй сценарий – это реакция металла с кислотой, когда металл вытесняет водород из кислоты и образуется соль. Например, цинк может реагировать с соляной кислотой:
Zn + 2HCl → ZnCl2 + H2
Если металл неспособен образовать электрическую связь с ионами соли, то между ними не происходит реакция. Например, алюминий не реагирует с нитратом натрия:
Al + NaNO3 → нет реакции
Таким образом, для взаимодействия солей с металлами необходимо наличие электрической связи между ионами металла и ионами из соли. Это является главным условием для возникновения реакции.
Химические свойства солей и их взаимодействие с металлами
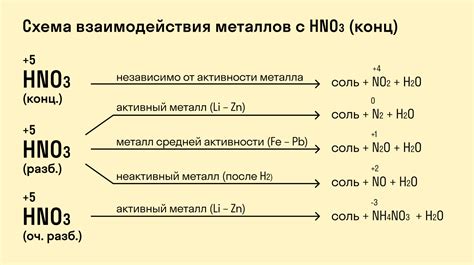
Соли - это химические соединения, состоящие из положительно и отрицательно заряженных ионов. Они образуются в результате реакции кислот с основаниями, при которой происходит обмен ионами.
Соли обладают рядом свойств, которые определяют их разностороннее взаимодействие с другими веществами. Одно из важных свойств солей - их возможность растворяться в воде и образовывать ионные растворы. При этом ионы солей свободно перемещаются в растворе и могут взаимодействовать с другими веществами.
Взаимодействие солей с металлами осуществляется по принципу обмена ионами. Металл может вытеснить из раствора ион соли, если его электрохимический потенциал выше электрохимического потенциала металла, который уже находится в растворе. В результате такой реакции происходит осаждение металла, а ионы соли переходят в раствор.
Часто взаимодействие солей с металлами сопровождается образованием осадка в виде металлических частиц или соединений металлов с другими элементами. Такие реакции могут протекать как в растворах, так и в твердом состоянии, возникая, например, при нагревании или окислении.
Взаимодействие солей с металлами имеет практическое значение и используется в различных отраслях промышленности. Например, процесс гальванизации основан на реакциях взаимодействия соли металла с поверхностью изделия, которое нужно покрыть покрытием из другого металла. Также взаимодействие солей с металлами основа процесса обработки руд и получения металлов из их рудных составляющих.
Электронная структура металлов и реакция с солями

Электронная структура металлов играет важную роль в их способности взаимодействовать с солями. Металлы обладают своеобразной "сеткой" свободных электронов, которая обеспечивает силу металлической связи. Такая связь позволяет металлам образовывать ионы положительного заряда и обменяться электронами с другими веществами.
При взаимодействии металлов с солями, образуется реакционное уравнение, которое показывает, какие вещества принимают участие в реакции и какие продукты образуются. Обычно в реакциях с солями металлы выступают в роли окислителей и передают электроны другим веществам.
Условием для реакции между металлами и солями является наличие разности электроотрицательностей между веществами. Металлы, обладающие менее высокой электроотрицательностью, имеют большую склонность отдавать электроны, потому что их энергетические уровни уже насыщены и они стремятся избавиться от свободных электронов. Это позволяет металлам реагировать с солями и образовывать ионы металла.
Однако, не все металлы способны вступать в реакцию с солями. Некоторые металлы, такие как золото и платина, обладают низкой активностью и не образуют ионов в реакции с солями. Это связано с их электронной структурой и насыщенностью энергетических уровней. Такие металлы считаются химически инертными и обладают высокой стойкостью к окислительным реакциям.
Влияние температуры на реакцию металлов с солями

Температура играет ключевую роль в процессе реакции металлов с солями. Исследования показывают, что изменение температуры может значительно влиять на скорость и характер реакции.
Увеличение температуры активирует реакцию между металлом и солью, ускоряя протекание процесса. При повышении температуры металлы обладают большей энергией, что позволяет им легче преодолеть энергетический барьер реакции и вступить в химическое взаимодействие с солями.
Кроме того, увеличение температуры способствует увеличению количества столкновений между частицами металла и соли, что также способствует более интенсивной реакции. Повышение температуры улучшает подвижность частиц и обеспечивает большую активность молекул, что приводит к ускорению реакции.
Однако стоит отметить, что слишком высокая температура может негативно сказаться на реакции металлов с солями. Высокая температура может привести к разрушению молекул соли или металлической структуры, что может препятствовать реакции или изменить ее механизм.
Выводом можно считать, что температура является важным фактором, которым следует управлять при реакциях между металлами и солями. Оптимальная температура должна быть выбрана таким образом, чтобы обеспечить достаточную активность металла и соли для реакции, не приводя при этом к нежелательным процессам разрушения.
Практическое применение реакции солей с металлами

Реакция солей с металлами – это процесс, в результате которого соли, содержащие положительно заряженные ионы металлов, реагируют с другими металлами, образуя новые соединения.
Практическое применение этой реакции находит широкое применение в различных областях:
- Металлургия: С помощью реакции солей с металлами производят множество металлических сплавов и соединений. Например, реакция хлорида цинка с алюминием приводит к образованию твердого сплава цинка с алюминием, который широко используется в металлургической промышленности.
- Электрохимия: В реакции солей с металлами происходит образование электрической энергии. Например, в гальванических элементах реакция меди с цинком позволяет получить электрический ток.
- Химический анализ: Реакция солей с металлами используется для определения наличия и концентрации металлов в различных образцах. Например, реакция соли серебра с натриевым хлоридом приводит к образованию белого осадка серебряной хлоридной соли, который используется в качестве реагента для анализа содержания серебра в образцах.
Кроме того, реакция солей с металлами находит применение в процессах гальванизации, гальванопластики, производстве красителей и прочих химических соединений.
Выводы и обобщение

Изучение взаимодействия солей с металлами позволяет сделать несколько выводов. Во-первых, для реакции между солью и металлом необходимо наличие определенных условий. Главным фактором, влияющим на возможность реакции, является электрохимический потенциал металла. Если потенциал металла выше, чем у иона металла в соли, то реакция может происходить.
Однако важно учитывать и другие факторы, такие как концентрация ионов соли, температура, наличие катализаторов и других веществ. Они могут ускорять или замедлять реакцию, а также влиять на ее характер и продукты. Например, высокая концентрация соли может способствовать разрушению металла, а низкая температура может замедлить реакцию или сделать ее невозможной.
Изучение взаимодействия солей с металлами важно для различных областей науки и техники, таких как химия, электрохимия, металлургия и др. Это позволяет понять принципы и механизмы данных реакций, а также использовать их в практических целях, например, для получения новых материалов, промышленного производства и решения проблем окружающей среды.
Таким образом, изучение взаимодействия солей с металлами позволяет расширить наши знания об основных принципах химических реакций, а также применить их для решения различных задач и задач технологических приложений. Более глубокое понимание этих процессов может привести к развитию новых материалов и методов, способных решить современные научные и технические проблемы.
Вопрос-ответ

Какое условие необходимо для реакции между солями и металлами?
Для реакции между солями и металлами необходимо, чтобы металл был более активным, чем металл, который содержится в соли. Также необходимо наличие достаточного количества ионов металла для реакции.
Почему металл должен быть более активным?
Металл должен быть более активным, потому что реакция металла с солью происходит за счет замещения металла в соли. Если металл будет менее активным, то он не сможет вытеснить металл из соли и реакция не произойдет.
Что происходит во время реакции между солями и металлами?
Во время реакции между солями и металлами происходит обмен ионами между металлом и солью. Металл вытесняет металл из соли, при этом образуется новая соль и образовавшийся металл отделяется от раствора.
