В химии существует множество веществ, которые могут реагировать между собой и образовывать новые соединения. Одним из таких видов химических реакций является взаимодействие сильных кислот с оксидами металлов. Сильные кислоты обладают высокой степенью электроотрицательности и способны передавать свои протоны налетучим веществам, в том числе оксидам металлов. Оксиды металлов, в свою очередь, являются соединениями металла с кислородом, которые могут реагировать с кислотами и образовывать соли и воду.
Взаимодействие сильных кислот с оксидами металлов происходит по закону сохранения массы и заряда. В процессе реакции кислота отдает протоны оксиду металла, который в свою очередь принимает эти протоны и становится соответствующим солью. При этом выделяется вода, которая является небольшим органическим природным ингредиентом реакции. Таким образом, в результате взаимодействия сильных кислот с оксидами металлов образуются новые соединения - соли металлов и вода.
Оксиды металлов являются основными оксидами, то есть они обладают щелочными свойствами и могут реагировать с кислотами. При этом, в зависимости от степени окисления металла, его оксиды могут обладать различной активностью. Сильные кислоты, такие как сульфатная кислота или хлорноватая кислота, образуют с оксидами металлов стабильные и достаточно инертные соединения. Такие реакции часто используются в промышленности для получения различных практических материалов и продуктов.
Сильные кислоты и оксиды металлов: взаимодействие и реакции
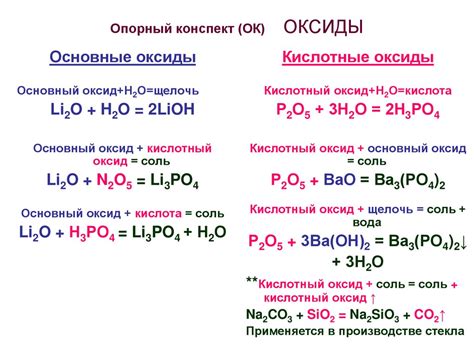
Сильные кислоты – это химические соединения, которые могут полностью отдавать свои протоны при реакции. Они обладают высокой степенью диссоциации в водных растворах и образуют катионы водорода (H+) при диссоциации. Примерами сильных кислот являются соляная кислота (HCl), сульфатная кислота (H2SO4) и азотная кислота (HNO3).
Оксиды металлов - это химические соединения, которые образуются при взаимодействии металлов с кислородом. Они могут быть основными, кислотными или амфотерными. Основные оксиды обладают щелочными свойствами и образуют гидроксиды при реакции с водой. Кислотные оксиды, напротив, образуют кислоты при взаимодействии с водой. Амфотерные оксиды могут проявлять как основные, так и кислотные свойства.
Взаимодействие сильных кислот с оксидами металлов приводит к образованию солей и воды. Это называется нейтрализационной реакцией. Например, при взаимодействии соляной кислоты (HCl) с щелочным оксидом металла, таким как оксид калия (K2O), образуется соль (KCl) и вода (H2O).
- Сильные кислоты обладают высокой степенью диссоциации и способны отдавать все свои протоны при реакции.
- Оксиды металлов могут быть основными, кислотными или амфотерными.
- Взаимодействие сильных кислот с оксидами металлов приводит к образованию солей и воды.
| Сильные кислоты | Оксиды металлов |
|---|---|
| Соляная кислота (HCl) | Оксид калия (K2O) |
| Сульфатная кислота (H2SO4) | Оксид натрия (Na2O) |
| Азотная кислота (HNO3) | Оксид магния (MgO) |
Что такое сильные кислоты?

Сильные кислоты – это химические соединения, которые в растворе обладают высокой активностью и обладают способностью высвобождать большое количество водородных ионов (H+). Они обладают сильной кислотностью и способны растворять многие металлы и их оксиды.
Основным свойством сильных кислот является их коррозионная активность. Они способны разъедать многие материалы, такие как металлы, кожу и ткани. Под воздействием сильных кислот может происходить образование дырок или коррозионных повреждений на поверхности материалов.
Сильные кислоты могут быть органическими или неорганическими соединениями. Некоторые из наиболее известных сильных кислот включают серную кислоту (H2SO4), хлороводородную кислоту (HCl), азотную кислоту (HNO3) и фтороводородную кислоту (HF).
Сильные кислоты играют важную роль в химической промышленности и можно встретить их в различных сферах, включая производство удобрений, очистку металлов и горное дело. Однако, необходимо обращать особое внимание на безопасность и правильное хранение сильных кислот, так как они могут быть опасными для здоровья и окружающей среды.
Свойства оксидов металлов
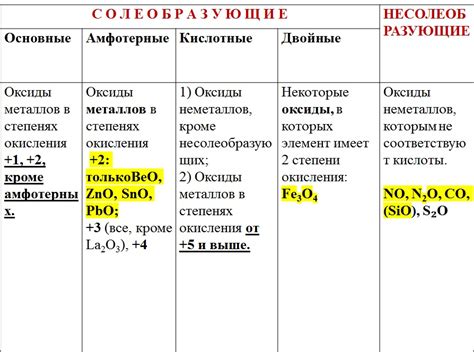
1. Растворимость в воде. Оксиды металлов могут быть различной степени растворимости в воде. Некоторые оксиды, например, оксиды щелочных металлов (натрия, калия), легко растворяются в воде и образуют растворы щелочной реакции. Однако, некоторые оксиды, такие как оксиды переходных металлов, плохо растворяются или вовсе не растворяются в воде.
2. Кислотность или щелочность растворов оксидов. Зависимость кислотности или щелочности растворов оксидов от тех или иных свойств металлов позволяет классифицировать оксиды как кислотные, щелочные или амфотерные. Например, оксиды переходных металлов имеют амфотерные свойства, то есть они могут выступать как в качестве кислоты, так и в качестве щелочи в растворах.
3. Физические свойства. Оксиды металлов обладают различными физическими свойствами, такими как плотность, температура плавления и кристаллическая структура. Некоторые оксиды, например, оксиды легких щелочных металлов, обладают низкой плотностью и низкой температурой плавления, что делает их полезными в различных технологических процессах.
4. Химическая активность. Оксиды металлов проявляют различную химическую активность в реакциях с другими веществами. Некоторые оксиды, такие как оксиды щелочных металлов, легко реагируют с кислородом из воздуха, образуя основные оксиды. Другие оксиды, например, оксиды переходных металлов, обладают высокой химической активностью и могут взаимодействовать с различными соединениями.
5. Катализаторы. Некоторые оксиды металлов обладают катализаторными свойствами, то есть они способны ускорять химические реакции. Катализаторы на основе оксидов металлов широко используются в промышленности для производства различных химических соединений, например, аммиака или серной кислоты.
В целом, свойства оксидов металлов зависят от химической природы металла, его электрохимических характеристик, а также от условий их синтеза и применения.
Процессы взаимодействия кислот с оксидами металлов

Кислоты — это вещества, способные высвобождать водородные ионы в водном растворе. Оксиды металлов представляют собой соединения, состоящие из металлического и кислородного атомов. При взаимодействии этих двух классов веществ образуются соли и вода, что является основным результатом реакции.
Процесс взаимодействия кислот с оксидами металлов можно представить в виде химического уравнения:
| Кислота | Оксид металла | Соль | Вода |
|---|---|---|---|
| Соляная кислота (HCl) | Оксид натрия (Na2O) | Хлорид натрия (NaCl) | Вода (H2O) |
| Азотная кислота (HNO3) | Оксид железа (Fe2O3) | Нитрат железа (Fe(NO3)3) | Вода (H2O) |
| Фосфорная кислота (H3PO4) | Оксид цинка (ZnO) | Фосфат цинка (Zn3(PO4)2) | Вода (H2O) |
Кроме образования солей и воды, взаимодействие кислот с оксидами металлов может сопровождаться выделением тепла и образованием газов. Такие процессы могут протекать быстро и являются важными в химической промышленности.
Основное правило взаимодействия кислот с оксидами металлов заключается в выборе правильного сочетания кислоты и оксида, чтобы получить нужное соединение. Кроме того, важно следить за правильными пропорциями веществ при проведении реакции. Взаимодействие кислот с оксидами металлов является сложной и интересной областью химии, которая находит применение во многих сферах нашей жизни.
Важность и применение

Взаимодействие сильных кислот с оксидами металлов является фундаментальным процессом, который находит применение во многих областях науки и технологии. Это взаимодействие позволяет получить соединения, которые могут быть использованы в различных промышленных процессах.
Одно из важных применений такого взаимодействия - получение растворов металлических солей. Эти растворы находят применение в различных областях промышленности, например, в гальванических процессах, при производстве покрытий и печатных плат. Растворы металлических солей также используются в процессе электролиза для получения чистых металлических отложений.
Кроме того, взаимодействие сильных кислот с оксидами металлов используется в процессе получения керамических материалов. В результате этого процесса образуются оксиды металлов, которые являются основными компонентами многих керамических материалов, таких как керамическая посуда, строительные материалы и термостойкие покрытия.
Кроме того, взаимодействие сильных кислот с оксидами металлов играет важную роль в процессе получения различных полупроводниковых материалов. Оксиды металлов, полученные в результате этого взаимодействия, могут быть использованы в производстве полупроводниковых приборов, таких как транзисторы и солнечные батареи.
Вопрос-ответ

Какие реакции происходят при взаимодействии сильных кислот с оксидами металлов?
Взаимодействие сильных кислот с оксидами металлов приводит к образованию солей и воды. В этом процессе протон (H+) из кислоты образует воду с кислородом из оксида металла, а катионы металла образуют соль с анионом из кислоты.
Какой окислительно-восстановительный потенциал имеют оксиды металлов?
Оксиды металлов имеют окислительно-восстановительный потенциал в зависимости от конкретного металла и его окислительного состояния. Например, оксид алюминия (Al2O3) имеет окислительно-восстановительный потенциал в районе +1,66 В, тогда как оксид меди (CuO) имеет потенциал около +0,34 В.
Почему взаимодействие сильных кислот с оксидами металлов сопровождается образованием солей?
Взаимодействие сильных кислот с оксидами металлов приводит к образованию солей в результате обменных реакций. Протон (H+) из кислоты замещает катион металла в оксиде, образуя соль, а кислород из оксида соединяется с водородом из кислоты и образует воду. Таким образом, происходит образование солей и воды при взаимодействии сильных кислот с оксидами металлов.
Какие металлы могут образовывать оксиды, взаимодействие с кислотами которых сопровождается выделением газа?
Некоторые металлы могут образовывать оксиды, взаимодействие с кислотами которых сопровождается выделением газа. Например, оксиды металлов группы 1 (натрия, калия) и группы 2 (магния, кальция) образуют газообразную воду при взаимодействии с сильными кислотами. Также, оксиды металлов группы 17 (хлора, брома, йода) могут образовывать газообразные галогены при взаимодействии с кислотами.
