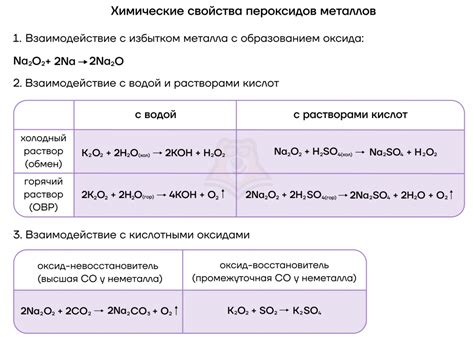
Щелочные металлы обладают высокой активностью и способностью реагировать с водой, что делает их важными химическими элементами. Реакция между щелочными металлами, такими как литий (Li), натрий (Na) и калий (K), и водой крайне быстра и энергична.
Во время реакции щелочный металл и вода образуют гидроксид щелочного металла и высвобождаются водородные газы. Уравнение реакции между литием и водой можно записать следующим образом:
2Li + 2H2O → 2LiOH + H2
Особенностью реакции щелочных металлов с водой является их способность образовывать энергичные и огнеопасные реакции. Натрий и калий, например, реагируют с такой интенсивностью, что вода может вспыхивать или даже взрываться при контакте с ними. Это связано с особенностями электронной структуры атомов щелочных металлов.
Реакция щелочных металлов с водой также имеет практическое значение. Щелочные металлы широко используются в промышленности и научных исследованиях, а их реакция с водой может быть использована в различных технических процессах, таких как производство водорода или очистка отходов.
Уравнения реакции щелочных металлов с водой
Реакция щелочных металлов с водой является химической реакцией, при которой щелочные металлы реагируют с водой, образуя основание и высвобождая водород. Уравнения для таких реакций могут быть записаны в следующем виде:
- Литий (Li) + Вода (H2O) → Гидроксид лития (LiOH) + Водород (H2)
- Натрий (Na) + Вода (H2O) → Гидроксид натрия (NaOH) + Водород (H2)
- Калий (K) + Вода (H2O) → Гидроксид калия (KOH) + Водород (H2)
На протяжении реакции, щелочный металл активно реагирует с молекулами воды. Металл замещает водород, образуя гидроксид щелочного металла и высвобождая водородный газ. Гидроксид является основанием, которое растворяется в воде, образуя гидроксидные ионные комплексы.
Реакция щелочных металлов с водой является альтернативным способом получения водорода. Эта реакция имеет важное применение в промышленности и научных исследованиях. Уравнения реакции помогают понять и предсказать результаты химических превращений, связанных с реакцией щелочных металлов и водой.
Особенности реакции щелочных металлов с водой

Реакция щелочных металлов с водой является характерной и важной химической реакцией. В этом процессе производятся щелочные гидроксиды и выделяется водород.
Давайте рассмотрим несколько особенностей этой реакции:
- Реакция щелочных металлов с водой является экзотермической, то есть сопровождается выделением тепла. Это объясняется тем, что образование гидроксида щелочного металла является высвобождением энергии.
- Реактивность щелочных металлов с водой возрастает по мере движения в периодической таблице снизу вверх. Например, литий наиболее реактивен из щелочных металлов, а калий наименее реактивен. Это связано с более слабой связью между металлом и гидроксидом при увеличении атомного радиуса металла.
- Важным аспектом реакции щелочных металлов с водой является выделение водорода. Водород образуется в результате реакции металла с водой и проявляется в виде пузырьков.
- При действии щелочных металлов на воду образуется щелочная растворимая соль и выделяется газообразный водород. Газообразный водород является легким и воспламеняется при контакте с открытым огнем. Поэтому данную реакцию следует проводить с осторожностью.
- Образование гидроксида щелочного металла приводит к образованию щелочной среды. Щелочные гидроксиды обладают основными свойствами и обычно имеют высокую щелочность.
Понимание особенностей реакции щелочных металлов с водой позволяет проводить химические эксперименты в лабораторных условиях и применять щелочные металлы в различных технических и промышленных процессах.
Вопрос-ответ

Что происходит при взаимодействии щелочных металлов с водой?
При взаимодействии щелочных металлов с водой происходит образование гидроксидов и выделение водорода. В результате этой реакции щелочные металлы активно реагируют с водой и образуют гидроксиды соответствующих металлов и водород в газообразном состоянии.
Какие металлы относятся к щелочным?
К щелочным металлам относятся литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Эти металлы характеризуются низкой плотностью и низкой плавкостью, а также их атомы обладают одной валентной электронной оболочкой.
