Щелочные металлы, такие как литий, натрий и калий, известны своей активной химической природой. Они имеют способность реагировать с различными веществами, включая воду. Процесс реакции щелочных металлов с водой может быть сопровожден выделением газа и образованием гидроксидов. Однако, есть нюансы в зависимости от конкретного металла и условий реакции.
Литий, расположенный в первой группе периодической системы, демонстрирует наиболее интенсивную реакцию с водой. При контакте с водой литий образует гидроксид лития и выделяет водород. Этот процесс сопровождается хлопком, а металл полностью растворяется в воде, образуя щелочную среду.
Натрий, второй элемент группы щелочных металлов, также реагирует с водой. В данном случае образуются гидроксид натрия и выделяется водород. Однако реакция происходит не так интенсивно, как в случае с литием, и не сопровождается хлопком или всплеском воды.
Калий, наиболее тяжелый элемент в группе щелочных металлов, также реагирует с водой, образуя гидроксид калия и выделяя водород. Однако реакция происходит еще медленнее и менее интенсивно, чем в случае с натрием. Калий также может образовывать гидроксид калия и водород при взаимодействии с водой при повышенных температурах.
Таким образом, щелочные металлы, включая литий, натрий и калий, реагируют с водой при комнатной температуре, образуя гидроксиды металлов и выделяя водород. Однако, степень интенсивности реакции может варьироваться в зависимости от конкретного щелочного металла и условий реакции.
Щелочные металлы: что это и каковы их свойства?
Щелочные металлы - это группа элементов периодической системы, включающая литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). У них характерные свойства, которые отличают их от других элементов.
Один из ключевых признаков щелочных металлов - их гидроксиды обладают щелочными свойствами, образуя щелочные водные растворы. Кроме того, щелочные металлы обладают низким потенциалом ионизации, что делает их очень реактивными. Они также имеют малую плотность, низкую температуру плавления и кипения, а также хорошую электропроводность.
Особенностью щелочных металлов является их реакция с водой. Когда щелочные металлы контактируют с водой при комнатной температуре, они активно реагируют, образуя водород и гидроксид металла. Реакция щелочных металлов с водой является экзотермической, то есть сопровождается выделением тепла. При этом образующийся водород выделяется в виде пузырьков, что делает реакцию заметной.
Таким образом, щелочные металлы - это реактивные элементы периодической системы, которые проявляют свою активность при контакте с водой при комнатной температуре. Их свойства и реактивность делают их интересными для многих научных и технических областей, а также позволяют использовать их в различных промышленных процессах и технологиях.
Реакция щелочных металлов с водой

Щелочные металлы - это элементы первой группы периодической системы: литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они отличаются высокой активностью и реакционной способностью, особенно при контакте с водой.
Реакция щелочных металлов с водой происходит по следующей схеме. При контакте с водой металл образует гидроксид этого металла и выделяет водород. Например, натрий (Na) реагирует с водой с образованием гидроксида натрия (NaOH) и выделением водорода (H2):
- 2Na + 2H2O -> 2NaOH + H2
В данной реакции частицы металла Na переходят из молекулы Na в ионно-молекулярный вид, образуя ион Na+. Окисление металла происходит при передаче двух электронов на молекулы воды. Ионный окислительный характер щелочных металлов проявляется именно в их способности отдавать электроны.
Реакция щелочных металлов с водой является сильно экзотермической, то есть сопровождается выделением большого количества тепла. В ходе реакции металл разрушается и образует гидроксид металла, который растворяется в образовавшейся щелочной воде.
Реакция щелочных металлов с водой является важным процессом в химическом и научном исследовании. Она используется, например, для получения водорода или для демонстрации реактивности этих металлов. Также она является одной из стандартных реакций в химических учебниках и лабораторных работах.
Влияние температуры на реакцию щелочных металлов с водой
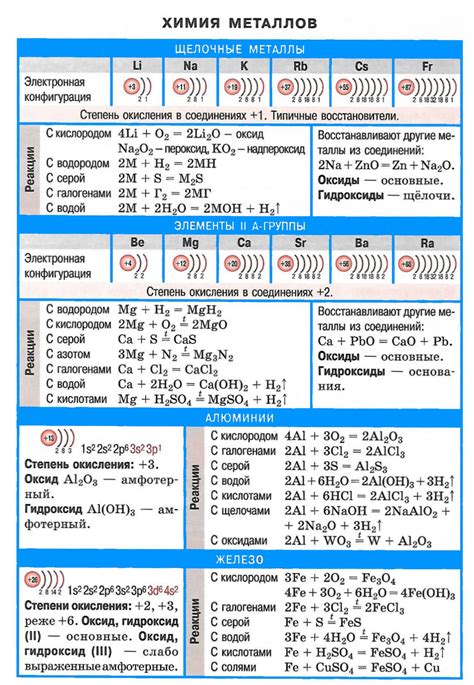
Щелочные металлы, такие как литий (Li), натрий (Na) и калий (K), реагируют с водой, образуя щелочные растворы и выделяя водород. Однако, реакция между щелочными металлами и водой может зависеть от температуры.
При комнатной температуре щелочные металлы активно реагируют с водой, образуя водородный газ и щелочные растворы. Эта реакция хорошо известна и используется как демонстрация химической активности металлов. Реакция протекает достаточно быстро и является экзотермической, то есть выделяет тепло.
Однако, при повышенной температуре реакция между щелочными металлами и водой может измениться. Например, при нагревании натрия до высоких температур реакция становится более взрывоопасной и интенсивной. Возникает сильное испарение воды и высвобождение большого количества водорода. Это связано с увеличением активности металла и способности реагировать с водой более интенсивно.
Таким образом, температура оказывает влияние на реакцию щелочных металлов с водой. При комнатной температуре реакция происходит определенным образом, в то время как при повышенных температурах она может быть более интенсивной и взрывоопасной. Изучение этого явления позволяет лучше понять и контролировать реакции щелочных металлов, а также применять их в различных областях науки и технологии.
Вопрос-ответ

Могут ли щелочные металлы реагировать с водой при обычной комнатной температуре?
Да, щелочные металлы, такие как натрий, калий и литий, обычно реагируют с водой при комнатной температуре.
Почему щелочные металлы реагируют с водой?
Щелочные металлы реагируют с водой из-за их высокой реактивности. Когда щелочный металл взаимодействует с водой, происходит химическая реакция, в результате которой образуется щелочная основа и выделяется водород.
