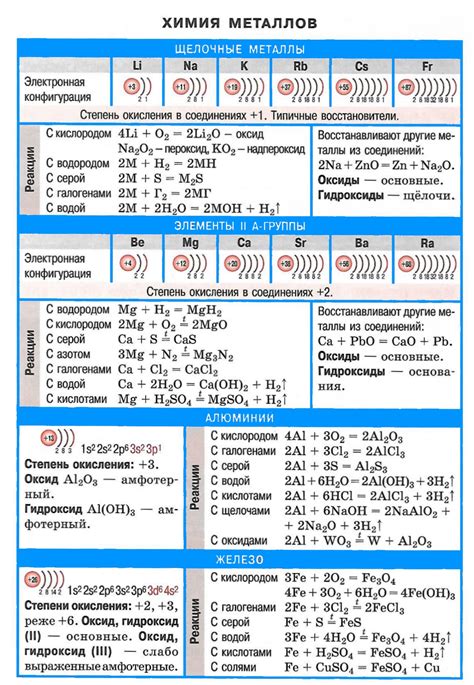
Щелочные металлы – это элементы I группы периодической системы Менделеева, которые взаимодействуют с водой. Эта химическая реакция может быть довольно интенсивной и сопровождаться выделением газа и разогревом смеси.
При взаимодействии щелочные металлы выступают в качестве активных металлов, отдавая свои внешние электроны воде и образуя ионы металла и ионы гидроксида. Именно реакция с водой определяет их высокую активность и растворимость. В свою очередь, среда воды реагирует с образовавшимися ионами гидроксида, приводя к образованию щелочной среды.
Познакомимся более подробно с реакциями каждого из щелочных металлов с водой, а также рассмотрим особенности, которые необходимо учесть: от способа проведения реакции до возможных опасностей и применений.
Взаимодействие щелочных металлов с водой: химические реакции и их особенности
Щелочные металлы, такие как литий, натрий и калий, обладают активным химическим поведением и реагируют с водой. Это взаимодействие приводит к образованию щелочей и выделению водорода. Химическая реакция происходит с выделением большого количества тепла.
Каждый щелочный металл взаимодействует с водой по-разному, но имеет общую особенность - реакция происходит с образованием гидроксида металла и выделением водорода. Например, литий прореагирует с водой, образуя гидроксид лития (LiOH) и высвобождая водородный газ (H2). Такая реакция может быть представлена следующим уравнением:
2Li + 2H2O → 2LiOH + H2
Реакция натрия с водой протекает более интенсивно и может быть представлена уравнением:
2Na + 2H2O → 2NaOH + H2
Калий также реагирует с водой аналогичным образом:
2K + 2H2O → 2KOH + H2
Важно отметить, что химическое взаимодействие щелочных металлов с водой происходит очень быстро и сопровождается выделением тепла и хлопком. Данное свойство может использоваться для практических целей, например, при использовании щелочных металлов в химических источниках тока или для получения водорода.
Также интересной особенностью взаимодействия щелочных металлов с водой является то, что оно происходит по эндотермическому механизму. Это означает, что реакция поглощает тепло из окружающей среды, что приводит к охлаждению. Во время реакции можно наблюдать образование пара и появление белого дыма, обусловленного образованием гидроксидов металлов.
Взаимодействие щелочных металлов с водой имеет практическое значение в различных отраслях, таких как энергетика, промышленность и наука. Изучение реакций данных металлов позволяет лучше понять их химические свойства и использовать их в различных технологических процессах.
Гидролиз натрия, калия и рубидия: основные черты взаимодействия с водой

Гидролиз щелочных металлов – это реакция их соединений с водой, при которой образуются щелочные гидроксиды и высвобождается водород. Натрий, калий и рубидий являются щелочными металлами и способны взаимодействовать с водой, образуя соответствующие гидроксиды: натриевый, калиевый и рубидиевый гидроксиды.
В процессе гидролиза натрия, калия и рубидия происходит активная реакция с водой, в результате которой образуется щелочное вещество, а также высвобождается водородный газ. Гидролиз этих металлов обусловлен их высокой активностью в химических реакциях и способностью взаимодействовать с водой.
Вода вступает в реакцию с щелочными металлами, образуя гидроксиды и освобождая молекулы водорода. Процесс гидролиза сопровождается выделением большого количества тепла, так как реакция с водой сопровождается выделением энергии. При этом гидроксиды натрия, калия и рубидия обладают крепким щелочным свойством и имеют важное применение в различных областях науки и промышленности.
Активность щелочных металлов при реакции с водой: что определяет скорость процесса

Взаимодействие щелочных металлов с водой является известной химической реакцией, при которой образуются щелочные гидроксиды и выделяется водород. Скорость этого процесса зависит от ряда факторов, которые определяют активность данных металлов.
Одним из главных факторов, определяющих скорость процесса, является электрохимический потенциал щелочных металлов. Чем выше значение потенциала, тем более активен металл и тем быстрее он реагирует с водой. Натрий и калий, например, обладают высокой активностью и быстро реагируют с водой, а литий поражительно активен и может даже самовозгораться при контакте с ней.
Также важным фактором является структура поверхности металла. Чем больше площадь поверхности, контактирующей с водой, тем больше возможных мест для реакции и тем быстрее протекает процесс. Поэтому металлы могут быть предварительно дроблены до мелких кусочков или представлены в виде порошка, чтобы увеличить активную поверхность.
Также в реакции важную роль играет температура. При повышении температуры вода обладает большей подвижностью и металлы более интенсивно взаимодействуют с ее молекулами. Следовательно, при высокой температуре реакция будет протекать быстрее.
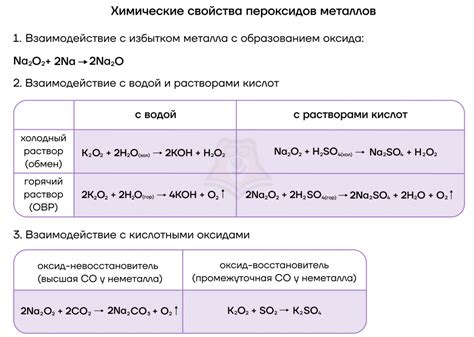
Наконец, кислотность раствора также влияет на процесс. Вода обладает некоторой кислотностью, поэтому произрастающая реакция может вызывать образование щелочей, что замедляет дальнейшую реакцию. Однако, при добавлении кислоты, взаимодействие металла с водой ускоряется.
Эксплозивные реакции щелочных металлов с водой: механизм и последствия
Реакция щелочных металлов с водой является одной из наиболее впечатляющих химических реакций. При контакте с водой эти металлы могут выделять газ в больших количествах и вызывать взрывы. Данный процесс обусловлен наличием в молекулах щелочных металлов высокоактивных электронов, что позволяет им связываться с водными молекулами и вызывать разрушительные реакции.
Механизм эксплозивной реакции щелочных металлов с водой заключается в том, что эти металлы реагируют с водой, образуя гидроксид и выделяя большое количество водорода. Например, литий при контакте с водой образует гидроксид лития и выделяет водородный газ. Реакция идет очень быстро и сопровождается глухим звуком взрыва, образованием пламени и выбросом металлических частиц.
Последствия эксплозивных реакций щелочных металлов с водой могут быть крайне опасными. Взрывы могут привести к возгоранию окружающего материала или зажечь одежду человека. Выделяющийся водород может привести к образованию взрывоопасной смеси с кислородом в воздухе. Кроме того, при взрывных реакциях могут образовываться кислотные растворы, которые могут причинить химические ожоги при контакте с кожей.
Важно отметить, что проведение экспериментов с щелочными металлами и водой требует особой осторожности и специальных условий безопасности. При работе с этими веществами необходимо использовать защитные очки, рукавицы и фумариционный шкаф. Также следует соблюдать правила хранения и утилизации таких веществ, чтобы предотвратить возможные аварии и травмы.
Вопрос-ответ

Какие металлы относятся к щелочным?
К щелочным металлам относятся литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr).
Почему щелочные металлы реагируют с водой?
Щелочные металлы реагируют с водой из-за высокой химической активности своих атомов. Реакция протекает следующим образом: металл образует гидроксид и выделяет водород.
Какова реакция лития с водой?
Реакция лития с водой проходит с образованием гидроксида лития (LiOH) и выделением водорода (H2).
Какие соединения образуются при взаимодействии натрия с водой?
При взаимодействии натрия с водой образуется гидроксид натрия (NaOH) и выделяется водород (H2).
