Щелочные металлы, такие как литий, натрий, калий и др., обладают высокой реакционной способностью. Их взаимодействие с солями происходит посредством образования ионных реакций, что позволяет использовать их в различных химических процессах и применениях.
Особенностью взаимодействия щелочных металлов с солями является образование растворимых солей. При смешении щелочного металла с солью происходит ионный обмен, в результате которого образуются ионы щелочного металла и ионы аниона соли. Это позволяет получать растворы, которые могут быть использованы в дальнейших химических процессах или применены в различных отраслях промышленности.
Взаимодействие щелочных металлов с солями часто используется в процессах получения различных химических соединений. Например, посредством реакции между щелочным металлом и хлоридом натрия или хлоридом калия можно получить гидроксиды соответствующих металлов - гидроксид натрия и гидроксид калия. Эти вещества являются основными и широко применяются как щелочные вещества в различных отраслях промышленности, в том числе в процессах производства стекла, мыла и щелочных аккумуляторов.
Щелочные металлы: обзор и свойства

Щелочные металлы – это элементы группы 1 периодической системы, включающие в себя литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они относятся к самым активным металлам и характеризуются высокой реакционной способностью.
Основные свойства щелочных металлов включают:
- Низкую плотность и мягкость. Щелочные металлы являются легкими и мягкими, легко поддаются формированию и разрезанию.
- Высокую электропроводность. Щелочные металлы являются отличными проводниками электричества, что делает их полезными в различных электронных устройствах и батареях.
- Низкую температуру плавления. Щелочные металлы обладают низкой температурой плавления, что делает их полезными в различных технологических процессах и при изготовлении сплавов.
- Высокую реакционность с водой и кислородом. Щелочные металлы легко реагируют с водой, выделяя водород и образуя щелочные растворы. Они также активно реагируют с кислородом, формируя оксиды.
Щелочные металлы находят широкое применение в различных отраслях промышленности и научных исследованиях. Они используются в производстве щелочных батарей, стеклопроизводстве, алюминиевой промышленности, фотоэлементах и многих других областях. Благодаря своей реакционной способности и уникальным свойствам, щелочные металлы являются важными компонентами многих химических процессов и материалов.
Взаимодействие щелочных металлов со солями: механизмы и закономерности

Взаимодействие щелочных металлов со солями - это процесс, при котором соли заменяются атомами щелочных металлов в результате химической реакции. Этот процесс осуществляется через обмен ионами, где ионы металла замещают ионы соли и образуют новые соединения.
Механизм взаимодействия щелочных металлов со солями основан на различии в электрохимической активности металла и иона соли. Щелочные металлы, такие как литий, натрий, калий, рубидий и цезий, имеют высокую активность и легко отдают электроны. Соли, с другой стороны, содержат ионы, которые могут принимать электроны.
Закономерности взаимодействия щелочных металлов со солями можно наблюдать при изучении их реактивности. Например, литий, самый активный щелочный металл, может замещать ионы всех остальных щелочных металлов в солях. Однако, между металлами существуют некоторые различия в реактивности, и некоторые металлы могут замещать только более низкореактивные металлы в солях.
Взаимодействие щелочных металлов со солями имеет различные практические применения. Многие соли щелочных металлов используются в качестве катализаторов, а также в процессах синтеза органических соединений. Кроме того, щелочные металлы находят широкое применение в различных отраслях, таких как металлургия, электроника и стекольная промышленность.
Основные реакции щелочных металлов с солями

Щелочные металлы, такие как литий, натрий, калий, рубидий и цезий, проявляют активное взаимодействие с солями. Эти реакции могут протекать с выделением газов и образованием осадков.
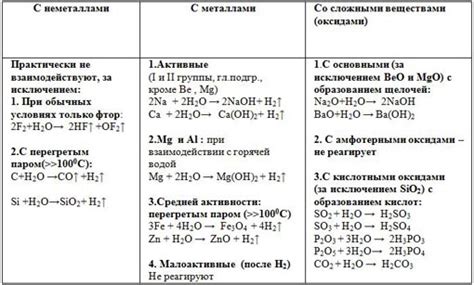
1. Реакция щелочных металлов с хлоридами:
При взаимодействии щелочных металлов с хлоридами, например, с хлоридом натрия (NaCl) или хлоридом калия (KCl), образуется соответствующий щелочной металл хлорид и выделяется хлор. Уравнение реакции может быть представлено следующим образом:
- 2Na + 2Cl2 → 2NaCl + Cl2
- 2K + 2Cl2 → 2KCl + Cl2
2. Реакция щелочных металлов с нитратами:
Взаимодействие щелочных металлов с нитратами, например, с нитратом калия (KNO3), приводит к образованию щелочной металл нитрата и выделению кислорода. Уравнение реакции может быть записано следующим образом:
- 2Na + 2KNO3 → 2NaNO3 + O2 + 2K
- 4K + 4KNO3 → 4KNO3 + O2 + 4K
3. Реакция щелочных металлов с сульфатами:
При взаимодействии щелочных металлов с сульфатами, например, с сульфатом натрия (Na2SO4) или сульфатом калия (K2SO4), образуются соответствующие щелочные металл сульфаты. Уравнение реакции представлено ниже:
- 2Na + Na2SO4 → 2Na2SO4 + S
- 2K + K2SO4 → 2K2SO4 + S
Таким образом, реакции щелочных металлов с солями возможны и имеют свои особенности в зависимости от вида соли.
Физические и химические свойства полученных соединений
Свойства щелочных металлов:
- Щелочные металлы, такие как литий, натрий, калий, рубидий и цезий, обладают металлическим блеском и серебристым цветом.
- Они обладают низкой плотностью и малой твердостью, что делает их мягкими и легко режущимися.
- Вещества, содержащие щелочные металлы, хорошо растворяются в воде, исключением является лишь литий, который имеет меньшую способность диссоциировать.
- Щелочные металлы обладают низкими точками плавления и кипения.
- Они хорошо проводят тепло и электричество.
Свойства полученных соединений:
- Реакция щелочных металлов с солями ведет к образованию различных типов соединений, таких как хлориды, нитраты, сульфаты и другие.
- Соединения щелочных металлов обычно обладают высокой растворимостью в воде.
- Многие из полученных соединений могут образовывать кристаллы, имеющие различные формы и структуры.
- Множество соединений щелочных металлов используется в различных областях, включая фармацевтику, производство стекла, катализ, пищевую промышленность и др.
Применение соединений щелочных металлов в промышленности и научных исследованиях
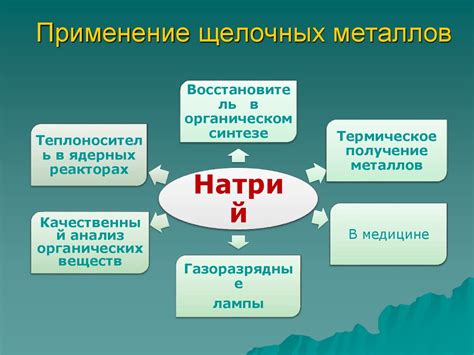
В промышленности:
- Соединения щелочных металлов широко используются в производстве стекла. Щелочные металлы, такие как натрий и калий, добавляются в стекломассу для повышения её плавкости и улучшения химической стойкости полученного материала.
- Они также применяются в качестве катализаторов в различных химических процессах. Активные ионные формы и окисные соединения щелочных металлов способны ускорять химические реакции и повышать их эффективность.
- Солями щелочных металлов можно вырабатывать широкий спектр продуктов, таких как мыло и моющие средства. Ионы щелочных металлов проявляют поверхностно-активные свойства, что способствует образованию пены и улучшает моющие свойства продуктов.
В научных исследованиях:
- Исследования в области электрохимии тесно связаны с использованием соединений щелочных металлов. Щелочные металлы часто используются в качестве электродных материалов и электролитов для исследования электрохимических процессов и разработки новых энергетических устройств.
- В качестве люминофоров и оптических материалов соединений щелочных металлов применяют в оптике и фотонике. Некоторые соединения щелочных металлов обладают уникальными оптическими свойствами, такими как люминесценция или фотолюминесценция, что находит применение в различных оптических устройствах и технологиях.
- Исследования в области вакуумной техники и электронной промышленности также используют соединения щелочных металлов. Например, вакуумные клетки для генерации и детектирования электронного ионизирующего излучения обычно заполняются гелием или ксеноном, которые являются соединениями щелочных металлов.
Таким образом, соединения щелочных металлов находят широкое применение в различных областях промышленности и научных исследований, благодаря своим особым свойствам и возможностям. Они играют важную роль в разработке новых материалов и технологий, а также способствуют развитию различных отраслей науки и промышленности.
Роль щелочных металлов в биологических системах

Щелочные металлы, такие как литий, натрий, калий, рубидий и цезий, играют важную роль в биологических системах. Они необходимы для нормального функционирования многих процессов в живых организмах.
Один из главных механизмов, в котором участвуют щелочные металлы, - это регуляция осмотического давления. Они способны притягивать и удерживать воду в клетках, что позволяет им поддерживать оптимальный водный баланс.
Щелочные металлы также являются неотъемлемой частью функционирования нервной системы. Они участвуют в передаче нервных импульсов, контролируют проницаемость клеточных мембран для ионов и участвуют в синтезе нейротрансмиттеров.
Еще одной важной функцией щелочных металлов является их участие в регуляции работы мышц и сердца. Они влияют на сократительную способность мышц и поддерживают ритм сердечных сокращений.
Кроме того, щелочные металлы играют важную роль в обмене веществ и транспорте кислорода в организме. Они участвуют в метаболических процессах и поддерживают нормальную работу клеток.
Наконец, щелочные металлы также имеют антиоксидантное действие. Они способствуют защите клеток от повреждений, вызванных свободными радикалами и окислительным стрессом.
Таким образом, щелочные металлы играют важную роль в биологических системах, обеспечивая нормальное функционирование клеток, органов и организмов в целом.
Взаимодействие щелочных металлов с солями и экология

Взаимодействие щелочных металлов с солями
Щелочные металлы, такие как литий, натрий, калий и др., с активностями действиями образуют соединения с солями. Взаимодействие между ними приводит к образованию новых веществ с различными свойствами. К примеру, хлорид натрия растворяется в воде и образует щелочную среду, а хлорид калия обладает схожими свойствами.
Экологические последствия
Взаимодействие щелочных металлов с солями может иметь негативные экологические последствия. Например, попадание раствора хлорида натрия, широко применяемого в промышленности и быту, в водные и почвенные ресурсы может вызывать загрязнение этих сред. Экосистемы, включая водные животные и растения, могут страдать от локального увеличения концентрации солей и нарушения химического равновесия. Это может привести к нарушению физиологических процессов в организмах и снижению биоразнообразия.
Однако, экологические последствия взаимодействия щелочных металлов с солями могут быть снижены при соблюдении мер предосторожности и контроля за выбросами в окружающую среду. Регулярный мониторинг и очистка загрязненных участков, применение эффективных методов утилизации отходов и соблюдение экологических стандартов позволяют минимизировать воздействие на окружающую среду и обеспечить устойчивость экосистем.
Таким образом, понимание взаимодействия щелочных металлов с солями и его экологических последствий является важным для нашего понимания взаимодействия человека с природой и разработки соответствующих стратегий охраны окружающей среды.
Вопрос-ответ

Какие щелочные металлы взаимодействуют с солями?
Щелочные металлы, такие как литий, натрий, калий, рубидий и цезий могут взаимодействовать с различными солями. Они реагируют с солями металлов, образуя новые соединения.
Какие реакции происходят при взаимодействии щелочных металлов с солями?
При взаимодействии щелочных металлов с солями может происходить обмен ионами, при котором ионы металла замещают ионы в соли. Также могут образовываться осадки, газы или происходить растворение соли.
Какие особенности имеет взаимодействие щелочных металлов с солями?
Одной из особенностей взаимодействия щелочных металлов с солями является высокая активность щелочных металлов, что позволяет им легко реагировать с разнообразными солями. Также взаимодействие может происходить с выделением тепла или образованием взрывоопасных реакций.
В каких областях применяется взаимодействие щелочных металлов с солями?
Применение взаимодействия щелочных металлов с солями включает такие области, как промышленная химия, синтез органических соединений, получение металлов и сплавов, производство биологически активных веществ и многое другое. Эти реакции нашли широкое применение в различных отраслях науки и промышленности.
