Щелочные металлы – это элементы первой группы периодической системы, включающей литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они характеризуются высокой реакционной способностью и являются самыми активными металлами. Взаимодействие щелочных металлов с неметаллами имеет свои особенности, определяющие химические свойства соединений, которые образуются.
Примером такого взаимодействия является реакция щелочных металлов с кислородом. При нагревании металла в атмосфере кислорода образуются оксиды щелочных металлов. Например, литий при взаимодействии с кислородом образует окалин, Na2O, рубидий – рубидий-II-оксид, RbO2. Реакция протекает с выделением большого количества теплоты.
Взаимодействие щелочных металлов с галогенами также происходит с образованием соединений. Галогены – это элементы седьмой группы (фтор (F), хлор (Cl), бром (Br), йод (I) и астат (At)), которые обладают высокой агрессивностью и реакционной способностью. При соприкосновении щелочных металлов с галогенами образуются соли, которые называются галогенидами. Например, натрий при взаимодействии с хлором образует хлорид натрия, NaCl, а калий с бромом образует бромид калия, KBr.
Как правило, взаимодействие щелочных металлов с неметаллами протекает с образованием ионных соединений. В ионной связи между металлическим катионом и неметаллическим анионом возникает электростатическое притяжение. Ионные соединения обладают определенными химическими и физическими свойствами, такими как высокая температура плавления и кипения, хрупкость, свойства проводить электрический ток в расплавленном или растворенном состоянии.
Таким образом, взаимодействие щелочных металлов с неметаллами – это процессы, при которых образуются химически стабильные соединения. Эти соединения имеют широкое применение в различных отраслях науки и техники, их свойства определяют их использование в процессах производства и в быту.
Реакция щелочных металлов с кислородом
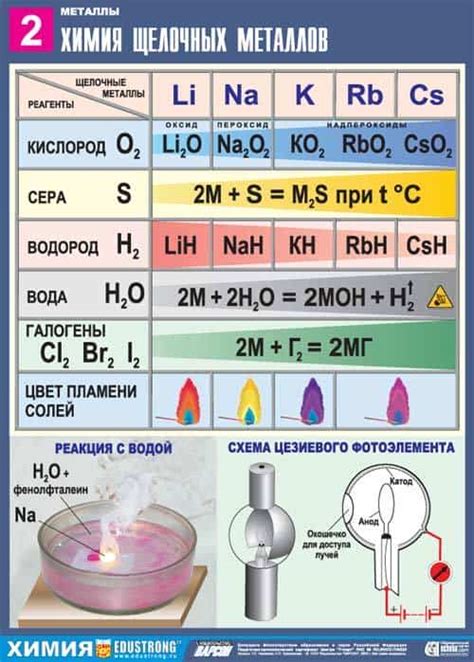
Щелочные металлы, такие как литий, натрий, калий, реагируют с кислородом и образуют соответствующие оксиды. Эти реакции являются химическими процессами, при которых происходит окисление щелочных металлов и образование оксидов.
Реакция щелочных металлов с кислородом происходит с выделением большого количества тепла и света. Например, при сжигании калия в кислороде образуется яркий огонь и образуются оксид калия (K2O).
Оксиды щелочных металлов обладают щелочными свойствами и растворяются в воде, образуя щелочные растворы. Например, оксид натрия (Na2O) реагирует с водой и образует натриевую щелочь (NaOH).
Реакции щелочных металлов с кислородом являются важными в химической промышленности и научных исследованиях. Они используются для получения оксидов щелочных металлов, которые находят применение в производстве стекла, керамики, щелочных батарей и других продуктах.
Взаимодействие щелочных металлов с водородом

Щелочные металлы, такие как литий, натрий, калий и др., могут вступать в реакцию с водородом. При этом образуются гидриды щелочных металлов, которые являются соединениями водорода и металла.
Взаимодействие щелочных металлов с водородом происходит при рекции металла с водородом при нагревании или при электролизе воды. В результате этой реакции образуются гидриды металлов, которые имеют важное применение в различных областях науки и техники.
Гидриды щелочных металлов обладают рядом химических и физических свойств. Они являются легкими, мягкими и реактивными веществами. Гидриды щелочных металлов могут растворяться в воде, образуя щелочные растворы.
Образование гидридов щелочных металлов с водородом имеет большое значение в производстве электричества, так как эти реакции могут использоваться в водородных топливных элементах. Гидриды щелочных металлов также используются в качестве катализаторов при производстве различных органических соединений.
Таким образом, взаимодействие щелочных металлов с водородом играет важную роль в химии и технологии и позволяет получать различные соединения с уникальными свойствами и широким спектром применения.
Реакция щелочных металлов с азотом

Щелочные металлы, такие как литий, натрий и калий, могут реагировать с азотом и образовывать соединения, известные как нитриды. Эта реакция происходит при высокой температуре и с образованием сильных связей между металлом и неметаллом.
Например, реакция лития с азотом приводит к образованию литиевого нитрида (Li3N). Это соединение является твёрдым и имеет кристаллическую структуру. Литиевый нитрид обладает высокой термической и химической стабильностью, что делает его полезным в различных промышленных процессах и технологиях.
Аналогичная реакция может происходить и с другими щелочными металлами. Например, реакция натрия с азотом приводит к образованию натриевого нитрида (Na3N). Это соединение также обладает структурой кристаллов и высокой стабильностью.
Реакция щелочных металлов с азотом является важным путем получения нитридов, которые могут иметь широкий спектр применений в материаловедении и электронике. Нитриды могут быть использованы в производстве полупроводниковых материалов, каталитических систем и других инновационных технологий.
Взаимодействие щелочных металлов с галогенами

Галогены – это элементы, относящиеся к группе 17 периодической системы. К ним относятся фтор, хлор, бром, иод и астат. Щелочные металлы, такие как литий, натрий, калий, рубидий и цезий, могут вступать в химическую реакцию с галогенами.
Взаимодействие щелочных металлов с галогенами является особенно активным и взаимно выгодным для обоих типов элементов. Щелочные металлы, обладая низкой электроотрицательностью, готовы отдать свой внешний электрон и образовать положительный ион (катион).
Галогены, в свою очередь, имеют высокую электроотрицательность и готовы принять электрон, чтобы образовать отрицательный ион (анион). В ходе реакции галогены забирают электрон у щелочных металлов, что приводит к образованию ионной связи между ними.
Реакции между щелочными металлами и галогенами являются экзотермическими – при их проведении выделяется тепло. Они могут протекать даже при низких температурах и могут быть использованы для получения соединений, таких как металлиды и соли галогенов.
Например, литий может вступать в реакцию с хлором, при которой образуется хлорид лития (LiCl). Аналогично, натрий способен образовывать хлорид натрия (NaCl), калий – хлорид калия (KCl), рубидий – хлорид рубидия (RbCl), а цезий – хлорид цезия (CsCl).
Реакция щелочных металлов с серой

Щелочные металлы, такие как литий, натрий, калий, рубидий и цезий, проявляют некоторую активность при взаимодействии с серой. Реакция этих металлов с серой может привести к формированию различных химических соединений.
Самым распространенным примером реакции щелочных металлов с серой является образование сульфидов. Когда щелочный металл вступает в контакт с серой в присутствии кислорода, он окисляется и образует сульфид этого металла. Например, при взаимодействии натрия с серой образуется натрийсульфид:
2Na + S → Na2S
Также щелочные металлы могут образовывать сульфиты, если процесс взаимодействия с серой протекает в условиях недостатка кислорода. В этом случае, щелочный металл окисляется до ионов с соответствующими протонами, а сера окисляется до сульфита:
4Na + 4S + O2 → 2Na2SO3
Иногда образуются и сульфаты, когда щелочный металл взаимодействует с серой в наличии избытка кислорода. В таком случае, металл окисляется до соответствующих ионов, а сера окисляется до сульфата:
8Na + 8S + 9O2 → 2Na2SO4
Таким образом, реакция щелочных металлов с серой может привести к образованию различных химических соединений, таких как сульфиды, сульфиты и сульфаты, в зависимости от условий реакции.
Взаимодействие щелочных металлов с фосфором

Фосфор – неметаллический элемент, который образует стойкие соединения со щелочными металлами. При взаимодействии фосфора с щелочными металлами образуются фосфиды, которые обладают различными свойствами и применяются в разных областях.
Фосфиды щелочных металлов – это химические соединения, в которых фосфоровый атом связан с атомами щелочных металлов. Некоторые фосфиды обладают высокой стабильностью и используются в качестве каталитических или полупроводниковых материалов.
Например, фосфид натрия, Na3P, обладает полупроводниковыми свойствами и применяется в электронике. Он может использоваться в солнечных панелях, светодиодах и других устройствах. Фосфиды щелочных металлов также применяются в процессе сплавления металлов и производстве специальных стекол.
Взаимодействие фосфора с щелочными металлами может быть очень разнообразным и зависит от условий реакции. Оно может протекать с образованием различных фаз и соединений. Некоторые фосфиды щелочных металлов обладают пирофорными свойствами, то есть способностью воспламеняться при контакте с воздухом.
Таким образом, взаимодействие щелочных металлов с фосфором является важным аспектом химии и находит применение в различных областях, начиная от электроники и заканчивая производством специализированных материалов. Изучение этих соединений позволяет расширить знания о химической природе элементов и их возможных применениях.
Реакция щелочных металлов с галлием

Галлий - это химический элемент, обозначаемый символом Ga и имеющий атомный номер 31. Процесс взаимодействия щелочных металлов с галлием представляет собой особый случай образования сплавов.
При взаимодействии наиболее активного щелочного металла - цезия (Cs) с галлием (Ga) образуется кристаллический соединение, называемое цезиевым галлием (CsGa). Этот сплав обладает высокой электропроводностью и широко применяется в электронике и при создании полупроводниковых приборов.
Также щелочные металлы, включая литий (Li), натрий (Na) и калий (K), могут реагировать с галлием, образуя сплавы. Эти сплавы также обладают полезными свойствами и применяются в различных отраслях промышленности.
Важно отметить, что взаимодействие щелочных металлов с галлием сопровождается энергетическими изменениями. При этом освобождается большое количество тепла, что может приводить к возгоранию и даже взрыву. Поэтому необходимо соблюдать осторожность при работе с этими веществами и проводить эксперименты только в специально оборудованных условиях.
Вопрос-ответ

Какие типы взаимодействия могут возникнуть между щелочными металлами и неметаллами?
Взаимодействие между щелочными металлами и неметаллами может проявляться в разных формах. Например, щелочные металлы могут реагировать с неметаллами, образуя ионные соединения. Они также могут образовывать молекулярные соединения, например, когда щелочные металлы реагируют с халогенами. Также известны случаи образования ковалентных соединений между щелочными металлами и некоторыми неметаллами.
Какие примеры взаимодействия щелочных металлов с неметаллами можно привести?
Один из известных примеров взаимодействия щелочных металлов с неметаллами - это реакция натрия с хлором, при которой образуется хлорид натрия (NaCl). Также можно привести пример реакции калия с кислородом, в результате которой образуется оксид калия (K2O). Другим примером является взаимодействие лития с серой, при котором образуется сульфид лития (Li2S).
Какие особенности характерны для взаимодействия щелочных металлов с неметаллами?
Одной из особенностей взаимодействия щелочных металлов с неметаллами является образование ионных соединений. В этих соединениях щелочные металлы отдают свои электроны неметаллам, образуя положительные ионы. Неметаллы, в свою очередь, принимают электроны и образуют отрицательные ионы. Также стоит отметить, что взаимодействие щелочных металлов с неметаллами может протекать с выделением большого количества тепла и образованием ярких пламенных реакций.
