Щелочные металлы являются одним из важнейших элементов в химии и науке в целом. Изучение их взаимодействия с различными соединениями имеет большое значение для понимания физико-химических процессов и развития новых технологий.
Одним из наиболее интересных объектов исследования является концентрированная азотная кислота (HNO3), которая является сильным окислителем и используется в различных отраслях промышленности. Взаимодействие этого соединения с щелочными металлами, такими как натрий (Na), калий (K) и литий (Li), вызывает ряд физико-химических процессов, которые имеют важное значение для практического применения.
Одним из результатов такого взаимодействия является образование нитратов щелочных металлов. Нитраты представляют собой важные химические соединения, которые находят широкое применение в промышленности и сельском хозяйстве. Взаимодействие азотной кислоты с щелочными металлами также может привести к образованию аммиака (NH3) и выделению газов, что имеет большое значение для процессов химической синтеза и производства удобрений.
Свойства концентрированной азотной кислоты

Концентрированная азотная кислота (HNO3) – химическое соединение, известное своей высокой степенью коррозии и окислительной активностью. Она является одним из наиболее сильных неорганических кислот.
Физические свойства:
- Концентрированная азотная кислота обладает светло-жёлтым или бесцветным цветом.
- Она имеет очень неприятный запах и может выделять ядовитые пары.
- Азотная кислота является жидкостью при комнатной температуре и обладает высокой плотностью.
- Точка плавления концентрированной азотной кислоты составляет около -42 градусов Цельсия.
- Точка кипения составляет около 83 градусов Цельсия.
Химические свойства:
- Концентрированная азотная кислота является сильным окислителем и может взаимодействовать с множеством веществ.
- Она способна окислять металлы, образуя оксиды и/или соединения азота.
- Азотная кислота может прореагировать с органическими веществами, вызывая их окисление и нередко внезапное воспламенение.
- HNO3 может действовать на кожу и другие органы, вызывая ожоги и другие серьезные повреждения.
Данные свойства делают концентрированную азотную кислоту ценным химическим веществом, но также источником опасности, требующим особых мер предосторожности при обращении с ней.
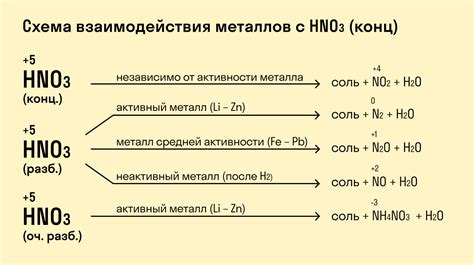
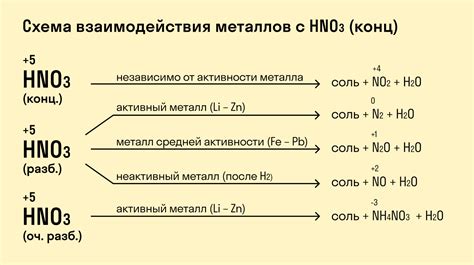
Реакция щелочных металлов с концентрированной азотной кислотой

Щелочные металлы (например, натрий, калий) обладают высокой реакционной активностью и способны реагировать с концентрированной азотной кислотой.
При контакте щелочных металлов с концентрированной азотной кислотой происходит интенсивное химическое взаимодействие. Реакция проходит с выделением значительного количества тепла и образованием соответствующих продуктов.
Результатом реакции щелочных металлов с азотной кислотой является образование азотнокислых солей. Например, при реакции натрия с концентрированной азотной кислотой образуется нитрат натрия (NaNO3), а при реакции калия - нитрат калия (KNO3).
Процесс реакции между щелочными металлами и концентрированной азотной кислотой может быть представлен схематически:
- Щелочной металл + концентрированная азотная кислота
- ⇒
- Азотнокислая соль + водород
Интересно отметить, что реакция щелочных металлов с концентрированной азотной кислотой является очень быстрой и взрывоопасной. При несоблюдении предосторожности возможно возникновение пожара или взрыва, поэтому данную реакцию следует проводить только в специально оборудованных лабораториях и при соблюдении всех необходимых мер безопасности.
Образование солей щелочных металлов и азотной кислоты
Образование солей щелочных металлов и азотной кислоты происходит на основе реакции между ионами щелочных металлов и анионами азотной кислоты. Эта реакция является типичной кислотно-щелочной реакцией, в которой кислота и щелочь образуют соль и воду.
Ионные реакции между щелочными металлами и азотной кислотой проходят в соответствии с ионным уравнением, в результате которого образуется соль щелочного металла и вода. Например, при реакции натрия (Na) с азотной кислотой (HNO3) образуется соль натрия (NaNO3) и вода (H2O).
Для ионного уравнения с реагентами и продуктами реакции между натрием и азотной кислотой можно записать следующую формулу: 2Na + 2HNO3 = 2NaNO3 + H2O. Расшифровывая эту формулу, можно увидеть, что две молекулы натрия реагируют с двумя молекулами азотной кислоты, образуя две молекулы нитратного натрия и одну молекулу воды.
Образование солей щелочных металлов и азотной кислоты является важной реакцией в химической промышленности, так как соли щелочных металлов широко используются в процессе производства удобрений, взрывчатых веществ, стекла и других важных промышленных продуктов.
Степень диссоциации солей щелочных металлов и азотной кислоты
Степень диссоциации солей щелочных металлов и азотной кислоты является важным показателем для понимания реактивности и химических свойств данных соединений. Диссоциация описывает процесс разделения соединения на его ионные компоненты под действием растворителя или при повышенных температурах.
В случае щелочных металлов, таких как натрий, калий и литий, они образуют соли, которые с легкостью диссоциируют в растворе. Это связано с их высокой электроотрицательностью и способностью образовывать ионы. Соли щелочных металлов, такие как хлорид натрия (NaCl) или нитрат калия (KNO3), расщепляются на ионы натрия, калия или лития и ионы соответствующей кислоты.
Степень диссоциации зависит от концентрации раствора и температуры. Чем выше концентрация соли или азотной кислоты, тем выше степень диссоциации. При повышении температуры, степень диссоциации также увеличивается.
Такие параметры, как ионная сила раствора, вязкость и температура, могут оказывать влияние на степень диссоциации солей щелочных металлов и азотной кислоты. Более высокая ионная сила и низкая вязкость способствуют более высокой степени диссоциации. Также известно, что температура оказывает влияние на кинетические характеристики диссоциации реагентов и может повысить их скорость.
Физические свойства полученных соединений

Полученные соединения, образованные в результате взаимодействия щелочных металлов с концентрированной азотной кислотой, обладают рядом характерных физических свойств.
Во-первых, данные соединения обычно являются кристаллическими веществами, состоящими из регулярно упорядоченной структуры атомов или ионов. Их кристаллическая решетка может иметь различные формы и структуры, что зависит от типа и количества металла, а также от условий синтеза.
Во-вторых, полученные соединения обладают характерными цветами, которые также могут зависеть от типа и количества металла, а также от степени окисления азота. Например, соединения, образованные с участием лития, могут иметь красноватый или фиолетовый цвет. При этом добавление или удаление электронов может приводить к изменению цвета соединения.
Кроме того, полученные соединения обычно обладают высокой термической и химической устойчивостью. Они обычно имеют высокую температуру плавления и кипения, что связано с сильной связью между атомами или ионами в кристаллической решетке. Также данные соединения обычно нерастворимы в воде и многих органических растворителях, что обусловлено их кристаллической структурой.
Применение полученных соединений
Полученные соединения щелочных металлов с концентрированной азотной кислотой могут быть использованы в различных областях промышленности и науки.
Первым и основным применением таких соединений является использование их в производстве удобрений. Щелочные металлы, такие как натрий и калий, являются необходимыми элементами для роста и развития растений. Поэтому полученные соединения могут быть использованы для создания удобрений, которые обеспечивают растения необходимыми питательными веществами.
Кроме того, полученные соединения могут быть использованы в производстве взрывчатых веществ. Натрий и калий являются ключевыми компонентами многих взрывчатых смесей и взрывов, таких как тротил и аммиачная селитра. Поэтому соединения щелочных металлов с концентрированной азотной кислотой могут быть использованы для создания эффективных взрывных веществ.
Кроме того, эти соединения могут быть использованы для создания оксидов щелочных металлов, которые широко используются в процессе стеклоплавления. Оксиды натрия и калия являются одними из основных компонентов стекла, и их наличие обеспечивает стеклу определенные свойства и характеристики. Поэтому полученные соединения могут быть использованы в производстве различных видов стекла, включая оконное стекло, посуду и лабораторную посуду.
В заключение, полученные соединения щелочных металлов с концентрированной азотной кислотой имеют широкий спектр применения в различных областях промышленности и науки. Их использование в производстве удобрений, взрывчатых веществ и стекла позволяет обеспечить растения, промышленные процессы и научные исследования необходимыми ингредиентами и материалами.
Вопрос-ответ

Каково влияние щелочных металлов на концентрированную азотную кислоту?
Щелочные металлы, такие как натрий, калий и литий, обладают сильным влиянием на концентрированную азотную кислоту. Они реагируют с ней, образуя соответствующие нитраты, а значит снижают ее концентрацию. Щелочные металлы также могут играть роль катализаторов в некоторых реакциях с азотной кислотой.
Может ли взаимодействие щелочных металлов с концентрированной азотной кислотой иметь опасные последствия?
Да, взаимодействие щелочных металлов с концентрированной азотной кислотой может иметь опасные последствия. Например, при реакции щелочного металла с азотной кислотой может выделяться большое количество тепла, что может привести к возгоранию или даже взрыву. Поэтому при работе с такими веществами необходимо соблюдать особые меры предосторожности.
Какие еще реакции могут происходить при взаимодействии щелочных металлов с азотной кислотой?
Взаимодействие щелочных металлов с азотной кислотой может вызывать различные реакции. Например, при реакции натрия с азотной кислотой образуется натрат натрия и оксид азота(II). Также, при реакции калия с азотной кислотой образуется калит и оксид азота(II). Литий также может реагировать с азотной кислотой, образуя соответствующий нитрат и оксид азота(II).
