Взаимодействие щелочных металлов с галогенами, серой, водородом и кислородом является одним из важных объектов изучения химии. Фундаментальные свойства и характеристики этих элементов позволяют лучше понять их взаимодействие и возможность образования различных соединений. В данной статье мы проанализируем некоторые суждения, связанные с этими взаимодействиями, с целью проверки их правдивости и достоверности.
Первым объектом нашего исследования будет взаимодействие щелочных металлов с галогенами. Галогены (фтор, хлор, бром, йод) являются очень активными элементами и обладают высокой электроотрицательностью. Взаимодействие галогенов с щелочными металлами приводит к образованию солей, которые позже могут использоваться в различных областях жизнедеятельности человека.
Кроме того, взаимодействие щелочных металлов с серой является также достаточно интересной областью исследования. Сера является распространенным элементом в природе и обладает разнообразными химическими свойствами. Щелочные металлы реагируют с серой, образуя соединения, которые могут использоваться в производстве удобрений, фармацевтической и нефтяной промышленности.
Исследование взаимодействия щелочных металлов с водородом и кислородом представляет особый интерес, так как эти элементы являются основными составляющими воды - вещества, необходимого для жизни всех организмов на Земле. Реакции щелочных металлов с водородом и кислородом приводят к образованию разнообразных соединений, которые активно используются в различных отраслях промышленности, в том числе в производстве энергии и производстве химических реактивов.
Исследование взаимодействия щелочных металлов с различными химическими элементами позволяет лучше понять их химические свойства и использовать их в практических целях, таких как производство лекарств, удобрений, энергии и других продуктов.
Взаимодействие щелочных металлов с галогенами

Галогены – это элементы группы №17 периодической таблицы, включающие в себя фтор, хлор, бром, йод и астат. Щелочные металлы, такие как литий, натрий, калий, рубидий и цезий, обладают высокой активностью и легко вступают в реакции с галогенами.
Взаимодействие щелочных металлов с галогенами протекает с образованием ионных соединений. Щелочные металлы отдают свой внешний электрон и образуют положительно заряженные ионы, а галогены принимают электрон и образуют отрицательно заряженные ионы. Образование ионных соединений обеспечивает стабильность системы и устойчивость реакций.
Взаимодействие щелочных металлов с галогенами сопровождается выделением большого количества тепла и света. Это явление называется экзотермической реакцией. Например, реакция натрия с хлором протекает с образованием хлорида натрия и сопровождается ярким свечением.
Ионные соединения, образующиеся в результате взаимодействия щелочных металлов с галогенами, обладают высокой растворимостью в воде. Это объясняется полярностью молекул ионных соединений – положительные ионы притягивают отрицательные ионы воды, что позволяет образовывать заряженные частицы и проводить электрический ток. Некоторые галогиды щелочных металлов, такие как хлориды и бромиды, растворяются хорошо, а фториды растворяются с трудом.
Щелочные металлы и их свойства

Щелочные металлы - это группа элементов, которые находятся в первой группе периодической системы. К ним относятся литий, натрий, калий, рубидий, цезий и франций. Эти металлы обладают низкой плотностью, благодаря чему могут плавать на поверхности воды.
Одной из основных характеристик щелочных металлов является их активность. Они очень реактивны и легко взаимодействуют с различными веществами. Например, щелочные металлы реагируют с водой, образуя щелочные гидроксиды и выделяя водород. Это свойство делает их очень опасными и требует соблюдения особых мер предосторожности при работе с ними.
Щелочные металлы также обладают яркими пламенем при сгорании. Они могут поджигаться простым прикосновением к огню. Кроме того, щелочные металлы имеют низкую температуру плавления и кипения, что позволяет им использоваться в различных технологических процессах.
Важным свойством щелочных металлов является их способность образовывать ионы с положительным зарядом. Они легко отдают свой электрон, что делает их хорошими электролитами для различных химических реакций.
Щелочные металлы также широко применяются в различных отраслях промышленности. Например, они используются для производства щелочей, а также в качестве катализаторов в различных химических процессах. Кроме того, щелочные металлы широко применяются в производстве аккумуляторных батарей, стекла и сплавов.
Галогены и их влияние

Галогены - это химические элементы семейства галогенов, которые включают фтор, хлор, бром, йод и астат. Они являются очень активными и реактивными элементами, что делает их важными участниками во многих химических процессах.
Галогены могут взаимодействовать с щелочными металлами, как натрием и калием, образуя соли. Эти соли обладают различными свойствами и находят широкое применение в промышленности и медицине.
Кроме того, галогены могут реагировать с серой, образуя галогеносульфиды. Эти соединения также обладают определенными свойствами и используются, например, в процессе хлорирования воды или в производстве химических препаратов.
Галогены могут взаимодействовать также с водородом, образуя соответствующие галогиды водорода. Эти соединения являются химически активными и используются в различных процессах, включая синтез органических соединений.
Наконец, галогены могут реагировать с кислородом, образуя галогеноксиды. Эти соединения обладают различными свойствами и используются, например, в процессе обработки промышленных отходов или в производстве окислителей.
Таким образом, галогены играют важную роль во многих химических реакциях и процессах, обладая разнообразными свойствами и находя широкое применение в различных сферах деятельности человека.
Экспериментальные исследования: проверка суждений

Для проверки правдивости суждений о взаимодействии щелочных металлов с галогенами, серой, водородом и кислородом были проведены эксперименты, направленные на изучение этих реакций.
На первом этапе исследований были выбраны щелочные металлы - литий (Li), натрий (Na), калий (K), рубидий (Rb) и цезий (Cs), а также галогены - фтор (F), хлор (Cl), бром (Br) и йод (I).
При экспериментах с галогенами было обнаружено, что щелочные металлы реагируют с ними, образуя соль. Например, соединение натрия и хлора образует поваренную соль (хлорид натрия), которая находится в состоянии кристаллов и обладает характерным соленым вкусом.
Другим существенным результатом экспериментов было выявлено, что щелочные металлы взаимодействуют с серой, образуя соответствующие сульфиды. Например, взаимодействие натрия с серой приводит к образованию сульфида натрия.
Реакция щелочных металлов с водородом приводит к образованию гидридов. Так, литий реагирует с водородом, образуя гидрид лития.
Взаимодействие щелочных металлов с кислородом приводит к образованию пероксидов или супероксидов. Например, реакция натрия с кислородом приводит к образованию пероксида натрия.
Исходя из результатов экспериментов, можно сделать вывод, что суждения о взаимодействии щелочных металлов с галогенами, серой, водородом и кислородом верны и подтверждаются полученными данными.
Реакция щелочных металлов с серой

Реакция щелочных металлов с серой является хорошо известным химическим процессом, проходящим под воздействием поверхностного активного вещества — серы. Щелочные металлы, такие как литий, натрий, калий, реагируют с серой, образуя соответствующие сульфиды, которые являются основной продукцией реакции.
Реакция щелочных металлов с серой протекает с выделением тепла и идет с образованием белого или серо-белого осадка, который является сульфидом щелочного металла. В процессе реакции щелочный металл экстрагирует серу из сероводорода или другого соединения серы, образуя при этом сульфид соответствующего металла.
Реакция щелочных металлов с серой — необратимый процесс. При добавлении щелочного металла к соединению серы происходит мгновенное образование сульфида щелочного металла и выделение газообразных продуктов реакции. При этом, в зависимости от условий, могут образоваться различные соединения, такие как сульфид, полисульфиды и тиосульфаты.
Взаимодействие щелочных металлов с водородом

Щелочные металлы (литий, натрий, калий и др.) обладают высокой реакционной способностью и вступают во взаимодействие с водородом. В результате такого взаимодействия образуется обильное количество водородного газа.
Процесс взаимодействия щелочных металлов с водородом протекает с выделением значительного количества тепла и характеризуется высокой скоростью реакции. При этом образующийся гидрид щелочного металла обладает гидролизующими свойствами - он реагирует с водой и образует гидроксид щелочного металла вместе с выделением еще большего количества водорода.
Взаимодействие щелочных металлов с водородом протекает по следующей реакционной схеме:
- Металлический щелочной металл + водород → гидрид щелочного металла
- Гидрид щелочного металла + вода → гидроксид щелочного металла + водород
Это взаимодействие имеет множество промышленных и научных применений. Например, щелочные металлы применяются в качестве катализаторов искусственного процесса выделения водорода, а также в процессе производства соединений водорода для использования в различных отраслях промышленности.
В заключение стоит отметить, что взаимодействие щелочных металлов с водородом является быстрым и энергетически интенсивным процессом, который находит свое применение в различных областях науки и промышленности.
Реакции щелочных металлов с кислородом
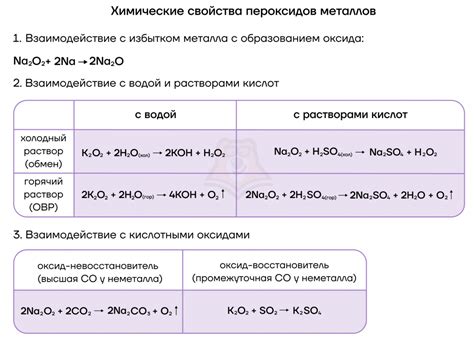
Щелочные металлы обладают высокой реакционной способностью и способны образовывать соединения с различными элементами, включая кислород.
Взаимодействие щелочных металлов с кислородом может протекать при различных условиях. Например, при нагревании металлического лития в атмосфере кислорода наблюдается образование оксида лития (Li2O).
Реакции щелочных металлов с кислородом также происходят при взаимодействии металлического натрия или калия с водой. При этом образуется гидроксид металла и выделяется водород. Например, при реакции натрия с водой образуется гидроксид натрия (NaOH) и выделяется водородный газ.
Важно отметить, что реакции щелочных металлов с кислородом в атмосфере могут протекать с высокой интенсивностью, сопровождаясь ярким свечением и выделением тепла. Поэтому при работе с щелочными металлами и кислородом необходимо соблюдать меры безопасности и избегать возможности возникновения опасных ситуаций.
Выводы и интересные факты

1. Взаимодействие щелочных металлов с галогенами приводит к образованию ионных соединений, таких как хлориды, бромиды и иодиды щелочных металлов. Это связано с высокой реакционной способностью галогенов и их способностью вступать в реакции окисления и восстановления.
2. Взаимодействие щелочных металлов с серой приводит к образованию сульфидов щелочных металлов. При этом образование соединений различается в зависимости от конкретного щелочного металла и условий реакции.
3. Взаимодействие щелочных металлов с водородом приводит к образованию гидридов щелочных металлов. Гидриды щелочных металлов являются сильными восстановителями и могут быть использованы в ряде химических реакций.
4. Взаимодействие щелочных металлов с кислородом приводит к образованию оксидов щелочных металлов. Оксиды щелочных металлов обладают основными свойствами и могут использоваться в различных процессах, таких как синтез стекла или производство щелочных растворов.
5. Интересным фактом является то, что щелочные металлы обладают высокой реакционной способностью и взаимодействуют с различными веществами, образуя разнообразные соединения. Это связано с их низкими ионизационными потенциалами и свойствами активных металлов.
6. Важно отметить, что взаимодействие щелочных металлов с галогенами, серой, водородом и кислородом является химическим процессом и может протекать с выделением тепла и образованием газов.
7. Подробное изучение взаимодействия щелочных металлов с различными веществами помогает понять основные закономерности химических реакций и применять полученные знания в различных областях науки и техники.
Вопрос-ответ

Какие элементы входят в группу щелочных металлов?
Группа щелочных металлов включает в себя элементы литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr).
Какие галогены взаимодействуют с щелочными металлами?
Галогены, такие как фтор (F), хлор (Cl), бром (Br) и йод (I), взаимодействуют с щелочными металлами.
Какие реакции происходят при взаимодействии щелочных металлов с галогенами?
При взаимодействии щелочных металлов с галогенами образуются соли. Например, реакция натрия (Na) с хлором (Cl) приводит к образованию хлорида натрия (NaCl).
Чем отличается реакция щелочных металлов с серой от реакции с галогенами?
Реакция щелочных металлов с серой приводит к образованию сульфидов, в то время как при взаимодействии с галогенами образуются соли. Например, реакция калия (K) с серой (S) приводит к образованию сульфида калия (K2S).
Что происходит при взаимодействии щелочных металлов с водородом и кислородом?
При взаимодействии щелочных металлов с водородом образуются гидриды, например, реакция лития (Li) с водородом (H2) приводит к образованию литиевого гидрида (LiH). При взаимодействии с кислородом образуются оксиды, например, реакция натрия (Na) с кислородом (O2) приводит к образованию оксида натрия (Na2O).
