Щелочные металлы являются группой элементов периодической системы, включающей литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Эти металлы характеризуются низкой плотностью, низкой температурой плавления и реактивностью. Одним из наиболее интересных аспектов их химических свойств является взаимодействие с азотом при обычных условиях.
При обычных условиях азот представляет собой газ и является стабильным молекулой N2. Щелочные металлы способны реагировать с азотом, образуя различные соединения. В химии такие реакции называются синтезом нитридов. Нитриды щелочных металлов обладают различными свойствами и находят применение в различных областях, включая катализаторы, материалы для электроники и покрытия.
Для взаимодействия с азотом щелочные металлы обычно нагреваются в атмосфере газа или включаются в реакцию с азотом. В результате образуются соединения, содержащие атомы азота и металлов. Эти соединения могут быть структурно различными, в зависимости от условий реакции и соотношения между металлом и азотом.
Взаимодействие щелочных металлов с азотом

Щелочные металлы - это элементы первой группы периодической системы, включающие литий, натрий, калий, рубидий и цезий. Низкое энергетическое состояние этих металлов делает их очень реактивными, и они образуют соединения с различными веществами, включая азот.
Первые три щелочных металла - литий, натрий и калий - реагируют с азотом при обычных условиях, образуя соединения, известные как нитриды. Эти реакции обычно происходят при нагревании металла с азотом или при введении азота в жидкой или газообразной форме. В результате образуются разнообразные нитриды щелочных металлов.
Например:
- Литий реагирует с азотом, образуя нитрид лития (Li3N), который имеет сильное основное действие и может использоваться в производстве разных химических соединений.
- Натрий реагирует с азотом и образует нитрид натрия (Na3N), важное соединение, используется в качестве каталитического вещества в синтезе различных органических соединений.
- Калий также обладает способностью реагировать с азотом, образуя нитрид калия (KN), который применяется в производстве взрывчатых веществ.
Реакция рубидия и цезия с азотом протекает труднее по сравнению с литием, натрием и калием, и, как правило, требует нагревания или использования специальных условий. Образующиеся нитриды щелочных металлов имеют различные свойства и применения.
Химические свойства щелочных металлов

Щелочные металлы представляют собой группу элементов периодической таблицы, включающую литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они характеризуются высокой химической активностью благодаря наличию одного электрона в валентной оболочке.
Щелочные металлы обладают способностью образовывать ионы положительного заряда (катионы) путем отдачи внешнего электрона. Это делает их очень реактивными элементами и хорошими восстановителями, способными вступать во взаимодействие со многими другими веществами.
Одним из характерных свойств щелочных металлов является их реакция с водой. При контакте с водой они немедленно реагируют, выделяя водород и образуя щелочные растворы. Например, натрий реагирует с водой по следующему уравнению: 2Na + 2H2O → 2NaOH + H2.
Щелочные металлы также образуют стабильные оксиды, обладающие амфотерными свойствами. Это означает, что они могут реагировать как с кислотами, так и с основаниями. Например, оксид калия (K2O) реагирует с водой, дающей щелочную реакцию. Однако, когда калиевый оксид соединяется с кислородом, образуется кислотный оксид K2O3.
Характеристики азота
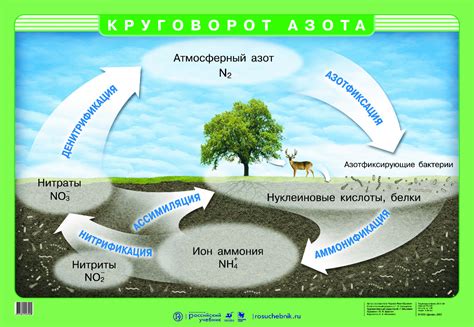
Азот - химический элемент, обозначаемый символом N и имеющий атомный номер 7. Этот неплавкий газ является основным компонентом атмосферы Земли, составляя около 78% ее объема. Азот также присутствует во множестве органических и неорганических соединений.
В свободном состоянии азот является двухатомным молекулами N2, которые обладают особой устойчивостью и низкой реакционной активностью. За счет этой устойчивости азот служит идеальным буфером для протекающих химических реакций в атмосфере и в растениях.
Азот обладает высокой электроотрицательностью, что делает его способным к образованию ковалентных связей с другими элементами. Он образует различные соединения, такие как аммиак (NH3), оксид азота (NO), нитриды, нитраты и многие другие.
Азот является необходимым питательным элементом для многих живых организмов, включая растения и животных. Растения используют азот для синтеза белков и других важных органических соединений. Животные, в свою очередь, получают азот из пищи и используют его для образования аминокислот, ДНК и других веществ.
Особенности взаимодействия щелочных металлов с азотом

Щелочные металлы, такие как литий, натрий и калий, обладают высокой активностью и реактивностью. При взаимодействии с азотом при обычных условиях, они образуют различные соединения, которые имеют важное значение как в химической промышленности, так и в научных исследованиях.
Одной из особенностей взаимодействия щелочных металлов с азотом является образование азидов. Азиды – это соединения, в которых азот связан с металлом и антионом азида. Азиды щелочных металлов характеризуются высокой стабильностью и являются важными преобразователями энергии. Например, азид лития (LiN3) применяется в качестве начального заряда для различных взрывчатых веществ.
Кроме того, взаимодействие щелочных металлов с азотом приводит к образованию нитридов. Нитриды щелочных металлов обладают высокой теплостойкостью и могут использоваться в качестве материалов для наноэлектроники. Они также проявляют полупроводниковые свойства, что делает их полезными для создания различных электронных устройств.
Таким образом, взаимодействие щелочных металлов с азотом при обычных условиях оказывает значительное влияние на различные области науки и промышленности. Азиды и нитриды щелочных металлов являются важными соединениями, которые находят применение во многих технологиях и процессах. Они открывают новые возможности для развития новых материалов и устройств.
Применение взаимодействия щелочных металлов с азотом

Взаимодействие щелочных металлов с азотом при обычных условиях может иметь различные применения. Один из способов использования этого взаимодействия - синтез азидов, органических и неорганических соединений, которые используются во многих областях науки и техники.
Азиды щелочных металлов, такие как натрий и калий, обладают хорошей растворимостью в воде, что делает их удобными для использования в различных химических реакциях. Например, они могут быть использованы в качестве окислителей во взрывчатых веществах, таких как тротил или толуолитролфталевый нитрамин. Кроме того, азиды щелочных металлов могут служить источником азидного иона в различных органических синтезах.
Взаимодействие щелочных металлов с азотом также может быть использовано для получения аммиака или амидов. В промышленности аммиак широко используется для получения обычных химических продуктов, включая азотную кислоту и удобрения. Амиды, в свою очередь, могут быть использованы в органической синтезе, в производстве лекарств или в качестве катализаторов в различных химических реакциях.
Вопрос-ответ

Какие есть щелочные металлы?
Щелочными металлами называются элементы первой группы периодической системы, а именно литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr).
Какие соединения могут образовываться при взаимодействии щелочных металлов с азотом?
При взаимодействии щелочных металлов с азотом образуются азиды (соединения, содержащие группу –N3, например, натриевый азид NaN3) и нитриды (соединения, содержащие атомы азота, например, литиевый нитрид Li3N).
