Щелочноземельные металлы - это группа химических элементов, включающая бериллий, магний, кальций, стронций, барий и радий. Эти металлы обладают отличными физическими и химическими свойствами, что делает их весьма интересными для исследования.
Взаимодействие щелочноземельных металлов со сложными веществами может приводить к различным реакциям и образованию новых соединений. Например, магний может реагировать с кислородом, образуя оксид магния, бериллий может образовывать сложные соединения с аминами и карбонатами, а кальций может образовывать стабильные соединения с органическими кислотами.
Взаимодействие щелочноземельных металлов со сложными веществами также может быть использовано в различных промышленных процессах. Например, бериллий используется в производстве сплавов для создания высокопрочных материалов, а кальций используется в производстве цемента и стекла.
Таким образом, изучение взаимодействия щелочноземельных металлов со сложными веществами имеет большое значение не только для понимания основ химии, но и для применения в различных областях науки и технологий.
Раздел 1: Основные свойства щелочноземельных металлов

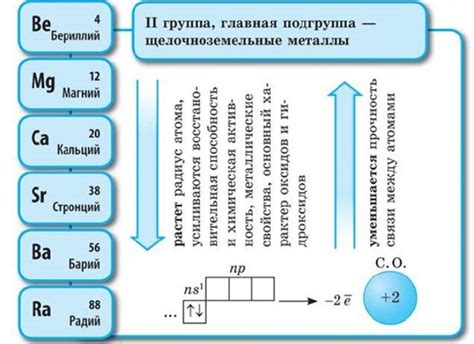
Щелочноземельные металлы – это элементы, которые находятся во второй группе (группа 2) периодической системы элементов. К ним относятся бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra). Они обладают рядом общих свойств, которые являются характерными для этой группы.
Первым основным свойством щелочноземельных металлов является их металлическая структура и химическая активность. Они обладают низкой электроотрицательностью и легко образуют ионы. Более того, они образуют двухвалентные ионы с положительным зарядом, утрачивая два электрона из своей внешней оболочки.
Вторым важным свойством щелочноземельных металлов является их реакционная способность с водой. Некоторые из них (например, кальций) реагируют с водой, выделяя водород и образуя оксид. Однако бериллий и магний с водой не реагируют.
Третьим значимым свойством щелочноземельных металлов является их способность образовывать стабильные соединения с различными комплексообразующими агентами и органическими соединениями. Это связано с наличием двух валентных электронов, утрачиваемых щелочноземельными металлами при образовании ионов.
В заключение, основные свойства щелочноземельных металлов, такие как их металлическая структура, химическая активность, реакционная способность с водой и способность образовывать стабильные соединения, делают их важными элементами во многих химических и технических процессах.
Раздел 2: Реакция щелочноземельных металлов с кислородом и воздухом
Щелочноземельные металлы обладают высокой активностью и способностью образовывать стабильные соединения с кислородом и воздухом. Их реакция происходит с выделением большого количества тепла и образованием трехвалентных оксидов, которые связаны в кристаллическую решетку.
Реакция щелочноземельных металлов с кислородом происходит при нагревании металла в кислородной среде или при воздействии на него кислородом при комнатной температуре. При этом образуется оксид металла и выделяется большое количество тепла. Например, реакция магния с кислородом протекает по следующему уравнению: 2Mg + O2 → 2MgO.
Взаимодействие щелочноземельных металлов с воздухом также является активным. При этом воздействии металлы могут гореть, образуя оксиды металла. Например, горение магния характеризуется ярким свечением и образованием белого порошка – оксида магния. Реакция горения представлена уравнением: 2Mg + O2 → 2MgO.
Оксиды щелочноземельных металлов обладают высокой щелочностью и могут реагировать с кислотами, образуя соль. Данные реакции имеют широкое применение в различных отраслях промышленности и научных исследованиях.
Раздел 3: Взаимодействие щелочноземельных металлов с водой

Вода - один из наиболее распространенных и важных веществ на Земле, имеющий множество свойств и способный вступать в химические реакции с различными веществами. Щелочноземельные металлы, такие как бериллий, магний, кальций, стронций, барий и радий, также взаимодействуют с водой, образуя различные соединения и проявляя свои химические свойства.
Вода является довольно слабым окислителем, но при взаимодействии с щелочноземельными металлами она проявляет свои окислительные свойства. При этом образуется гидроксид металла и высвобождается водород. Реакции взаимодействия щелочноземельных металлов с водой обычно протекают довольно медленно и с увеличением атомного номера металлов скорость реакции уменьшается.
Например, бериллий практически не реагирует с водой, в то время как магний реагирует медленно, образуя гидроксид магния и высвобождая водород. Кальций и другие щелочноземельные металлы реагируют с водой более интенсивно, образуя соответствующие гидроксиды и также высвобождая водород.
Взаимодействие щелочноземельных металлов с водой также может приводить к образованию растворимых гидроксидов, которые ионизируются в растворе. Гидроксиды этих металлов обладают амфотерными свойствами, то есть они могут реагировать как с кислотами, так и с основаниями. Это свойство делает их важными реагентами в различных химических процессах.
Раздел 4: Реакция щелочноземельных металлов с органическими соединениями

Реакция щелочноземельных металлов с органическими соединениями представляет собой взаимодействие этих металлов с различными органическими веществами. Щелочноземельные металлы, такие как магний, кальций и барий, обладают большой химической активностью и способны образовывать стабильные соединения с органическими веществами.
Одной из наиболее известных реакций является реакция щелочноземельных металлов с органическими кислотами. При этом образуется соль и выделяется молекула воды. Например, при реакции магния с уксусной кислотой образуется уксат магния и выделяется молекула воды.
Кроме того, щелочноземельные металлы могут реагировать с органическими спиртами, образуя спиртаты. Например, реакция магния с метанолом приводит к образованию метанолата магния.
Реакциями щелочноземельных металлов с органическими соединениями можно оперировать, чтобы получить различные органические продукты. Такие реакции активно применяются в органической химии для синтеза различных соединений.
Вопрос-ответ

Какие сложные вещества реагируют с щелочноземельными металлами?
Щелочноземельные металлы, такие как магний, кальций, стронций и барий, могут реагировать с различными сложными веществами, включая органические соединения и неорганические соединения. Они могут взаимодействовать с органическими кислотами, аминами, эфирами, альдегидами и кетонами. Кроме того, щелочноземельные металлы могут образовывать комплексы с анионами и молекулами, такими как хлориды, сульфаты, карбонаты и оксиды.
Какие свойства имеют соединения щелочноземельных металлов с кислотами и основаниями?
Соединения щелочноземельных металлов с кислотами и основаниями обладают определенными свойствами. Например, реакция щелочноземельных металлов с кислотами обычно приводит к выделению газа. Например, реакция магния с соляной кислотой приводит к выделению водорода. Кроме того, соединения щелочноземельных металлов с основаниями обычно образуют растворимые соли, которые могут быть использованы в различных областях, таких как медицина, промышленность и сельское хозяйство.
