Щелочноземельные металлы - это элементы, которые находятся во второй группе периодической системы: бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra). Они обладают рядом общих свойств, в том числе низкой плотностью, высокой температурой плавления и реакционной способностью.
Однако, несмотря на эти свойства, щелочноземельные металлы не взаимодействуют с водой при нормальных условиях. Это означает, что они не растворяются и не реагируют со взятой партией воды в обычных температурах и давлениях.
Причина отсутствия взаимодействия металлов с водой заключается в структуре и свойствах атомов щелочноземельных элементов. Их внешняя электронная оболочка заполнена 2-мя электронами, что делает ее стабильной и менее реакционной. Кроме того, металлы имеют низкую электроотрицательность, что затрудняет образование ионов и реакцию с водой.
Особенности взаимодействия щелочноземельных металлов и воды

Взаимодействие щелочноземельных металлов и воды представляет собой специфический процесс, отличающийся от реакций других металлов с водой. В отличие от щелочных металлов, таких как натрий или калий, щелочноземельные металлы, такие как магний или кальций, реагируют с водой очень медленно или практически не реагируют в обычных условиях.
Одной из причин отсутствия активного взаимодействия щелочноземельных металлов с водой является их электрохимическая стабильность. Отличительной особенностью этих металлов является их низкая реакционная способность, связанная с высокой ионизационной энергией и электронной конфигурацией. Это приводит к тому, что водородные ионы, получаемые от воды, не слишком активно соединяются с щелочноземельными металлами, и поэтому реакция протекает медленно или не протекает вообще.
Другим фактором, влияющим на отсутствие взаимодействия, является образование стойкой пассивной окисной пленки на поверхности щелочноземельных металлов. Воздействие кислорода из воды приводит к образованию окиси металла, которая затем формирует защитную пленку на поверхности металла. Эта пленка предотвращает дальнейший контакт воды с металлом и замедляет или полностью подавляет реакцию.
Тем не менее, некоторые щелочноземельные металлы могут взаимодействовать с водой с образованием щелочи и выделением водорода. Например, магний реагирует с водой при нагревании или в присутствии катализаторов, образуя гидроксид магния и выделяя водородный газ. Такие реакции происходят при повышенных температурах и не относятся к обычным условиям взаимодействия.
Причины недостатка взаимодействия

Одной из причин недостатка взаимодействия щелочноземельных металлов с водой является их высокая электроотрицательность. Щелочноземельные металлы, такие как магний, кальций и стронций, имеют высокую электроотрицательность, что делает их малореактивными в отношении воды.
Второй причиной отсутствия взаимодействия щелочноземельных металлов с водой связана с их структурой и электронной конфигурацией. Щелочноземельные металлы имеют два электрона на внешней оболочке, что делает их более стабильными и менее склонными к реакциям с другими веществами. Это приводит к тому, что металлы слабо реагируют с водой и не образуют продуктов реакции.
Третья причина связана с образованием покрытия оксида на поверхности металла. При контакте с водой щелочноземельные металлы образуют оксидные пленки, которые накапливаются на поверхности металла и предотвращают дальнейшее взаимодействие с водой. Эти пленки обладают защитными свойствами и препятствуют дальнейшей реакции металла с водой.
В целом, все эти факторы в совокупности приводят к недостатку взаимодействия щелочноземельных металлов с водой при нормальных условиях. Это делает эти металлы малореактивными и стабильными в присутствии воды, что находит свое применение в различных областях науки и промышленности.
Химические свойства щелочноземельных металлов

Щелочноземельные металлы - это элементы второй группы периодической таблицы, которые включают бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra). Эти металлы имеют схожие химические свойства и обладают рядом общих черт.
Перечисленные щелочноземельные металлы хорошо растворимы в кислотах. Например, бериллий образует растворы со соляной и серной кислотами, а магний может растворяться даже в соляной кислоте при нагревании. Кальций также реагирует с кислотами, образуя соответствующие соли и выделяя водород.
Щелочноземельные металлы обладают высокой электроотрицательностью, что делает их реактивными и способными образовывать различные соединения. Например, они могут образовывать оксиды (как бериллий оксид и магний оксид), гидроксиды (как гидроксид кальция и гидроксид стронция) и соли (как карбонат бария и нитрат радия).
Один из особых аспектов химических свойств щелочноземельных металлов - их низкая реактивность с водой при нормальных условиях. Они взаимодействуют с водой медленно и незначительно, в отличие от щелочных металлов (например, лития, натрия и калия), которые с водой реагируют более активно, выделяя водород и образуя гидроксиды. Это связано с более высокой электроотрицательностью щелочных металлов, поэтому они гораздо активнее.
Химические свойства щелочноземельных металлов широко применяются в различных областях. Например, бериллий используется в производстве сплавов для создания легких и прочных материалов. Магний применяется в производстве сплавов, легких конструкций и широко используется в автомобильной промышленности. Кальций находит применение в производстве сталей, а также в фармацевтической и пищевой промышленности.
Степень реактивности воды с щелочноземельными металлами

Щелочноземельные металлы представляют собой группу элементов, включающую бериллий, магний, кальций, стронций, барий и радий. При обычных условиях вода обычно не реагирует с этой группой металлов. Это связано с их стабильной электронной конфигурацией и высокой электроотрицательностью.
Щелочноземельные металлы имеют два валентных электрона в своей внешней энергетической оболочке, что делает их реактивными металлами. Однако, в случае взаимодействия с водой, реактивность этих металлов значительно снижается. Причиной этого является образование защитной пленки оксида металла на поверхности металла, которая предотвращает дальнейшую реакцию с водой.
Например, магний, один из самых реактивных щелочноземельных металлов, образует пленку оксида магния (MgO) на своей поверхности при контакте с водой. Эта пленка является непроницаемой для воды и предотвращает дальнейшую реакцию магния с водой.
Таким образом, хотя щелочноземельные металлы обладают высокой реактивностью при взаимодействии с другими веществами, они практически не реагируют с водой при нормальных условиях. Это делает их полезными для различных применений, таких как производство сплавов, магниевые сплавы и другие материалы.
Реакция металлов с водой при нормальных условиях
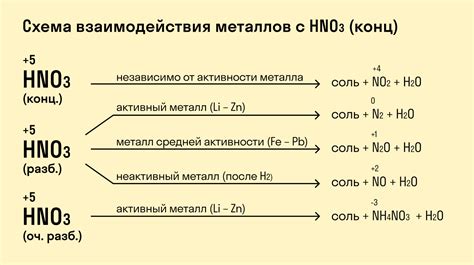
Металлы имеют свойства, которые определяют их реакцию с водой. Щелочные металлы, такие как литий, натрий и калий, реагируют с водой с выделением водорода и образованием гидроксидов. Однако, в отличие от этих металлов, щелочноземельные металлы, такие как магний, кальций и стронций, не проявляют активности при контакте с водой при нормальных условиях.
Это объясняется тем, что атомы щелочноземельных металлов имеют меньшую энергию ионизации по сравнению с атомами щелочных металлов. Это означает, что энергия, необходимая для отщепления электрона от атома металла, меньше. Следовательно, атомы щелочноземельных металлов менее активны в химических реакциях.
Этот факт объясняет отсутствие реакции щелочноземельных металлов с водой при нормальных условиях. В противоположность этому, в случае с щелочными металлами, реакция с водой является яркой и с активным выделением газа. Это происходит из-за более высокой активности щелочных металлов в химических реакциях и более низкой энергии ионизации.
Таким образом, отсутствие реакции щелочноземельных металлов с водой при нормальных условиях объясняется их химическими свойствами, включая энергию ионизации и активность в химических реакциях. Это демонстрирует различия между различными группами металлов и влияние их электронной структуры на реакцию с веществами окружающей среды.
Влияние переменных факторов на реакцию с водой
Интеракция щелочноземельных металлов с водой является достаточно сложным процессом, зависящим от множества переменных факторов. Основные из них - это химические свойства металлов, температура, давление, концентрация раствора и среда.
- Химические свойства металлов определяют их способность образовывать соединения с водой. Щелочноземельные металлы реагируют с водой, образуя гидроксиды, при этом выделяется большое количество энергии.
- Температура и давление оказывают значительное влияние на скорость реакции. При повышении температуры и давления скорость реакции возрастает.
- Концентрация раствора также влияет на скорость реакции. При повышенной концентрации раствора скорость реакции увеличивается.
- Атмосферные условия и среда играют важную роль в реакции щелочноземельных металлов с водой. В среде с высокой кислотностью или щелочностью реакция может протекать более интенсивно.
Таким образом, переменные факторы имеют существенное влияние на процесс взаимодействия щелочноземельных металлов с водой. Изменение одного из этих факторов может привести к изменению характеристик реакции, таких как скорость и эффективность.
Важность отсутствия взаимодействия щелочноземельных металлов с водой
Отсутствие взаимодействия щелочноземельных металлов с водой при нормальных условиях имеет важное значение в различных сферах нашей жизни.
Во-первых, это связано с безопасностью. Щелочноземельные металлы, такие как магний, кальций и стронций, обладают высокой реактивностью и могут вызывать опасные химические реакции при контакте с водой. Если бы эти металлы реагировали с водой, то это могло бы привести к возникновению пожаров или даже взрывам в присутствии больших количеств воды, что несомненно является серьезной угрозой для людей и окружающей среды.
Во-вторых, отсутствие взаимодействия щелочноземельных металлов с водой позволяет им использоваться в различных технических и промышленных процессах. Их устойчивость к воде позволяет использовать эти металлы в конструкциях, подвергающихся воздействию влаги, без опасения их быстрого разрушения или коррозии. Кроме того, данное свойство позволяет использовать щелочноземельные металлы в производстве аккумуляторов и других электрохимических устройств.
В-третьих, отсутствие взаимодействия щелочноземельных металлов с водой способствует сохранению водных ресурсов. Если эти металлы были бы реактивными по отношению к воде, то они могли бы испортить качество воды и сделать ее не пригодной для питья или использования в хозяйственно-бытовых нуждах. Это также имеет важное значение для поддержания экологического баланса в водных экосистемах и сохранения разнообразия жизни.
Таким образом, отсутствие взаимодействия щелочноземельных металлов с водой при нормальных условиях является важным фактором, который обеспечивает безопасность, позволяет использовать эти металлы в различных отраслях промышленности и сохранять водные ресурсы для будущих поколений.
Практическое применение данного открытия

Открытие о невзаимодействии щелочноземельных металлов с водой при нормальных условиях имеет значительное практическое применение в различных сферах. В частности, данное открытие находит применение в производстве аккумуляторов.
Благодаря своей устойчивости к воде, щелочноземельные металлы могут быть использованы в качестве анодов в аккумуляторах. Это позволяет создавать более эффективные аккумуляторы с повышенной емкостью и длительным сроком службы.
Кроме того, отсутствие взаимодействия щелочноземельных металлов с водой позволяет применять их в производстве высокочувствительных электронных компонентов. Например, щелочноземельные металлы могут быть использованы в качестве частей контактов или проводников, обеспечивая стабильность и надежность работы электронных устройств.
Кроме того, щелочноземельные металлы могут быть использованы в производстве специальных материалов, таких как устойчивые покрытия или катализаторы. Возможность использования этих металлов в различных областях открывает новые перспективы для разработки инновационных технологий и материалов.
Вопрос-ответ

Что такое щелочноземельные металлы?
Щелочноземельные металлы - это группа металлов второй группы периодической системы элементов, которые включают магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra). Они химически активны и имеют два электрона в своей внешней электронной оболочке.
Почему щелочноземельные металлы не реагируют с водой?
Отсутствие реакции щелочноземельных металлов с водой объясняется их высокой ионизационной энергией и низкой электроотрицательностью. Вода, будучи полярной молекулой, образует водородные связи с соседними молекулами воды, что делает ее структуру более устойчивой. Щелочноземельные металлы не способны нарушить эту устойчивую структуру, поэтому не происходит реакции с водой.
Если щелочноземельные металлы не реагируют с водой, то с какими веществами они могут реагировать?
Щелочноземельные металлы могут реагировать с рядом других веществ, включая кислород, азот, галогены (фтор, хлор, бром, йод), серу и фосфор. Например, они образуют оксиды при реакции с кислородом и нитриды при взаимодействии с азотом. Также щелочноземельные металлы могут образовывать соли с кислотами и образовывать соединения с неорганическими и органическими соединениями.
Что произойдет, если попытаться погрузить щелочноземельный металл в воду?
Если попытаться погрузить щелочноземельный металл, например, магний, в воду при нормальных условиях, то ничего значительного не произойдет. Магний будет находиться в воде в виде неподвижного слоя оксида или гидроксида на поверхности металла, что позволяет ему избегать дальнейшего взаимодействия с водой.


