В химии щелочноземельные металлы представляют собой группу элементов, состоящую из бериллия (Be), магния (Mg), кальция (Ca), стронция (Sr), бария (Ba) и радия (Ra). Эти металлы обладают сходными свойствами и химическими реакциями.
Одним из интересных аспектов исследования щелочноземельных металлов является их взаимодействие с растворами кислот. Кислоты представляют собой химические вещества, имеющие свойства передавать протонные ионы в растворе. При контакте с растворами кислот щелочноземельные металлы проявляют различную реактивность и способность образовывать соли.
К примеру, магний (Mg) проявляет активность при взаимодействии с кислотами. Он растворяется в различных кислотах, таких как соляная (HCl) или серная (H2SO4), образуя соли и выделяяся в виде газа. Также магний может реагировать с кислотными оксидами, образуя соответствующие соли и воду. Кальций (Ca) также проявляет схожую активность и реакцию с растворами кислот.
Физико-химические свойства щелочноземельных металлов

Щелочноземельные металлы - это группа элементов в периодической таблице, которая включает бериллий, магний, кальций, стронций, барий и радий. Они имеют ряд общих физико-химических свойств, которые делают их уникальными и широко используемыми в различных областях.
Первое заметное свойство щелочноземельных металлов - это их низкая плотность. Они являются легкими металлами, что облегчает их использование в различных приложениях, включая авиацию и автомобильную промышленность.
Второе важное свойство - химическая реактивность. Щелочноземельные металлы реагируют с водой и кислородом, образуя оксиды и гидроксиды. Это позволяет использовать их в реакциях со многими другими элементами и соединениями.
Также следует отметить хорошую термическую и электрическую проводимость щелочноземельных металлов. Они являются отличными проводниками тепла и электричества, что делает их полезными в производстве кабелей, проводов и различных электронных устройств.
Интересно отметить также их способность образовывать стойкие соединения с другими веществами. Например, барий может образовывать тяжелые соли, которые используются в медицинских и промышленных целях.
Кроме того, щелочноземельные металлы обладают яркими цветами, которые делают их популярными в производстве пигментов для красок и косметики.
Итак, общие физико-химические свойства щелочноземельных металлов - это низкая плотность, химическая реактивность, высокая термическая и электрическая проводимость, способность образовывать стойкие соединения и наличие ярких цветов. Эти свойства делают щелочноземельные металлы незаменимыми во многих областях техники, науки и промышленности.
Реакция щелочноземельных металлов с кислотами
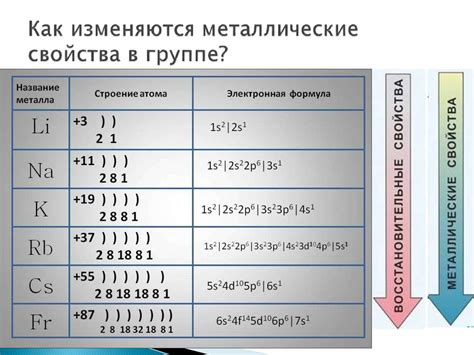
Щелочноземельные металлы, такие как магний, кальций, стронций и барий, проявляют химическую реакцию при взаимодействии с различными кислотами. Эта реакция заключается в том, что щелочноземельные металлы образуют соли и выделяются их ионы, а кислоты диссоциируются, образуя положительные водородные ионы и отрицательные остатки.
Одной из наиболее широко известных реакций щелочноземельных металлов с кислотами является реакция с соляной кислотой (HCl). При этом образуются хлориды металлов и выделяются бесцветные и нетоксичные ионы водорода.
Другой пример реакции взаимодействия щелочноземельных металлов с кислотами - это реакция с серной кислотой (H2SO4). В результате этой реакции образуются сульфаты металлов и выделяются два иона водорода. Отметим, что серная кислота является сильной кислотой, поэтому реакция проходит более интенсивно и выделение газа может наблюдаться более ярко.
Также интересной является реакция щелочноземельных металлов с уксусной кислотой (CH3COOH). В результате этой реакции образуются ацетаты металлов и выделяются ионы водорода. Оксид углерода также может образовываться в результате реакции, особенно при нагревании.
Таким образом, реакция щелочноземельных металлов с кислотами является важным процессом в химии и имеет множество практических применений, включая получение различных солей и водородного газа. Это свидетельствует о значимости исследования взаимодействия этих веществ в химических процессах.
Применение щелочноземельных металлов в химической промышленности

Щелочноземельные металлы, такие как магний, кальций, стронций и барий, находят широкое применение в химической промышленности благодаря своим уникальным свойствам и реакционной способности.
Магний является одним из наиболее распространенных щелочноземельных металлов, который широко используется в производстве сплавов, гальваническом покрытии, легировании стали и алюминия. Магниевые сплавы обладают высокой прочностью при небольшом весе, что делает их идеальными для использования в авиационной и автомобильной промышленности.
Кальций используется в производстве стали и алюминия, а также в качестве добавки в стекле, цементе и керамике. Кальций также востребован в производстве химических реактивов и фармацевтических препаратов.
Стронций и барий находят применение в производстве пиротехнических композиций, таких как фейерверки и сигнальные ракеты. Они обладают способностью гореть ярко и долго, что делает их идеальными для использования в различных аттракционах.
Вопрос-ответ

Что такое щелочноземельные металлы?
Щелочноземельные металлы - это группа химических элементов, которая включает в себя бериллий, магний, кальций, стронций, барий и радий. Эти металлы характеризуются низкой плотностью, низкой температурой плавления и мягкостью. Они также обладают высокой реакционной способностью и активностью при контакте с кислотами.
Какое взаимодействие происходит между щелочноземельными металлами и растворами кислот?
Щелочноземельные металлы реагируют с растворами кислот, образуя соответствующие соли и выделяя водород. Реакция протекает с образованием большого количества тепла. Например, при реакции магния с соляной кислотой образуется хлорид магния и выделяется водород:
Какие факторы влияют на скорость взаимодействия щелочноземельных металлов с кислотами?
Скорость взаимодействия щелочноземельных металлов с кислотами зависит от нескольких факторов. Один из них - концентрация кислоты. Чем выше концентрация кислоты, тем быстрее протекает реакция. Также важными факторами являются температура и поверхность металла. Высокая температура и большая поверхность металла способствуют увеличению скорости реакции.
В чем применение реакции щелочноземельных металлов с кислотами?
Реакция щелочноземельных металлов с кислотами имеет несколько практических применений. Например, магний реагирует с соляной кислотой, используется в процессе получения хлорида магния, который широко используется в промышленности. Кроме того, этот тип реакций широко используется в лабораторных условиях для получения солей и водорода.
