Металлы являются одной из основных групп элементов периодической таблицы Менделеева. Открыты металлы на ранних этапах истории человечества, и они сыграли огромную роль в его развитии. Однако, металлы не являются стабильными в природе и активно реагируют с различными веществами.
Одной из наиболее распространенных групп веществ, с которыми металлы взаимодействуют, являются щелочи. Щелочи - это щелочные гидроксиды, включающие гидроксид натрия, гидроксид калия и другие. Они обладают высокой щелочностью и способностью образовывать растворы с высоким уровнем pH.
Взаимодействие металлов с щелочью вызывает ряд химических реакций, которые могут быть как полезными, так и опасными. Один из примеров полезного взаимодействия - образование щелочных металлов, таких как натрий и калий, при реакции щелочей с соответствующими металлами. Эти металлы широко используются в промышленности и научных исследованиях.
Однако, взаимодействие металлов с щелочью также может привести к опасным реакциям. Некоторые металлы, такие как алюминий и цинк, могут растворяться в щелочях с образованием высокоэнергетических соединений, которые довольно взрывоопасны. Поэтому, взаимодействие металлов с щелочью требует особой осторожности и контроля.
Важно учитывать, что взаимодействие металлов с щелочью зависит от их химических свойств и реакционных условий. Различные металлы могут образовывать разные продукты реакций с одной и той же щелочью. Поэтому, изучение взаимодействия металлов с щелочью является важным аспектом химической науки и имеет множество практических применений.
Взаимодействие металлов с щелочью: роль веществ

Взаимодействие металлов с щелочью является одним из ключевых процессов в химии. Оно основано на образовании сильных ионных связей между металлами и щелочью. Однако, роль в этом процессе играют не только металлы и щелочи, но и другие вещества.
Важную роль во взаимодействии металлов с щелочью играют растворители, такие как вода. Растворители позволяют реакции проходить более быстро и эффективно, так как они разрывают связи между металлами и их ионами, облегчая их перемещение и взаимодействие с щелочью.
Кроме того, важную роль играют катализаторы – вещества, которые ускоряют химические реакции, но при этом не расходуются сами по себе. Катализаторы способствуют разрушению связей между металлами и их ионами, образованию новых связей и образованию промежуточных соединений, которые затем превращаются в конечные продукты реакции.
Помимо этого, взаимодействие металлов с щелочью может протекать в присутствии ингибиторов – веществ, которые замедляют химические процессы и предотвращают отрицательные побочные реакции. Ингибиторы могут стабилизировать промежуточные продукты реакции и предотвратить нежелательную реакцию между металлом и щелочью.
Взаимодействие металлов с щелочью – сложный процесс, в котором активно участвуют различные вещества. Роль в этом процессе играют растворители, катализаторы и ингибиторы, которые влияют на скорость и характер реакции, обеспечивая эффективное взаимодействие металла с щелочью.
Металлы и их свойства

Металлы – это химические элементы, которые характеризуются отличительными свойствами, такими как высокая теплопроводность, электропроводность и пластичность. Они обладают блестящей поверхностью и способностью отдавать электроны в реакциях с другими веществами.
Физические свойства металлов:
- Проводимость электричества: металлы обладают высокой электропроводностью, что делает их необходимыми материалами для производства проводов, контактов и электрических приборов.
- Проводимость тепла: металлы являются хорошими теплопроводниками, что позволяет им распространять и равномерно распределять тепло.
- Пластичность: металлы способны изменять свою форму без разрушения и сохранять новую форму после охлаждения. Это свойство позволяет использовать их для изготовления различных деталей и конструкций.
- Магнитные свойства: некоторые металлы обладают магнитными свойствами, такими как железо и никель, что делает их полезными для создания магнитов и магнитных систем.
Химические свойства металлов:
- Взаимодействие с кислотами: металлы активно реагируют с кислотами, образуя соли и выделяя водородный газ.
- Взаимодействие с щелочами: металлы также взаимодействуют с щелочами, образуя соли и выделяя водородный газ. При этом, реакция может проходить более интенсивно или пассивно в зависимости от свойств конкретного металла и щелочи.
- Коррозионная стойкость: некоторые металлы (например, золото и платина) обладают высокой коррозионной стойкостью и не окисляются воздухом, что делает их полезными для производства украшений и электронных компонентов.
- Способность к окислению: многие металлы могут окисляться под воздействием кислорода воздуха, что влечет за собой образование оксидов, таких как ржавчина.
Изучение свойств металлов позволяет понять их роль и применение в различных областях науки, техники и промышленности.
Щелочь и ее характеристики

Щелочь – это химическое вещество, обладающее высокой щелочностью. Она относится к классу соединений, которые растворяются в воде, образуя гидроксиды. Щелочь обычно имеет высокий уровень pH и обладает щелочным вкусом.
Основные характеристики щелочи включают:
- Щелочность – способность щелочи нейтрализовать кислоты. Она может восстанавливать pH кислого раствора, превращая его в щелочной.
- Растворимость в воде – щелочные вещества хорошо растворяются в воде, образуя гидроксиды.
- Щелочной вкус – многие щелочные растворы имеют отчетливый щелочной вкус.
- Способность образовывать соли – при взаимодействии с кислотой щелочь образует соль и воду.
- Высокий уровень pH – щелочные растворы имеют pH выше 7 и могут быть крайне щелочными.
В природе щелочные вещества часто встречаются в виде минералов, например, гидроксид натрия (щавельная сода) и гидроксид калия (каустическая сода). Они широко используются в различных областях, включая химическую промышленность, фармацевтику, стекольную и мыльную промышленность.
Что происходит при взаимодействии металлов и щелочи

Взаимодействие металлов с щелочью может привести к различным химическим реакциям и образованию новых веществ. Основным результатом такого взаимодействия является образование гидроксидов металлов, которые являются основаниями и, как правило, обладают щелочными свойствами.
Вода играет ключевую роль в процессе реакции металла и щелочи. При контакте с водой металлы образуют ионы, которые взаимодействуют с молекулами воды, образуя гидроксиды. Например, натрий (Na) образует гидроксид натрия (NaOH), а калий (K) - гидроксид калия (KOH).
Взаимодействие металлов с щелочью может быть сопровождено выделением водорода. Некоторые металлы, такие как алюминий (Al), магний (Mg) или цинк (Zn), могут реагировать с щелочью с образованием гидроксидов и выделением водорода. Реакция металла с щелочью может быть очень интенсивной и сопровождаться выделением большого количества пузырьков газа.
Также при взаимодействии металлов и щелочи может образовываться осадок в виде нерастворимых гидроксидов. Например, при взаимодействии меди (Cu) с гидроксидом натрия (NaOH) образуется нерастворимый гидроксид меди (Cu(OH)2), который образует осадок в виде темной массы или порошка.
Роль гидроксидов
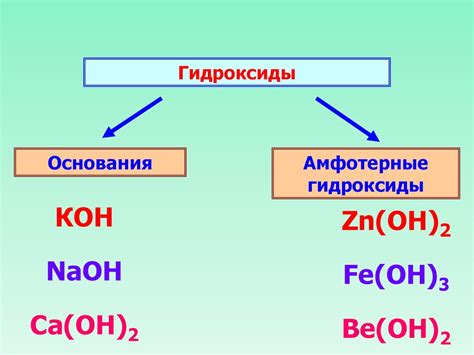
Гидроксиды играют важную роль во взаимодействии металлов с щелочью. Они образуются при реакции металлов с водой и являются одним из основных продуктов этого процесса.
Гидроксиды металлов обладают щелочными свойствами и широко используются в различных отраслях промышленности. Они могут быть использованы в качестве катализаторов, а также для получения различных продуктов химической синтеза.
Гидроксиды играют важную роль не только в промышленности, но и в жизни организмов. Например, гидроксид кальция, известный как известь, используется в строительстве и в медицине.
Взаимодействие металлов с гидроксидами представляет собой химическую реакцию, в результате которой образуются соли и вода. Этот процесс широко используется в химической промышленности для получения различных продуктов.
Гидроксиды металлов, благодаря своим свойствам, позволяют проводить реакции в щелочной среде и обладают высокой реакционной способностью, что делает их незаменимыми в процессах производства химических соединений.
Вывод: гидроксиды играют важную роль во взаимодействии металлов с щелочью, обладая щелочными свойствами и применяясь в различных отраслях промышленности.
Влияние щелочи на коррозию металлов
Щелочь, или щелочное вещество, взаимодействует с различными металлами и может оказывать как положительное, так и отрицательное влияние на их коррозию. Коррозия металлов подразумевает процесс их разрушения под воздействием окружающей среды.
Щелочные растворы могут способствовать коррозии некоторых металлов, особенно алюминия и магния, ускоряя окисление и разрушение их поверхностей. В таких условиях может происходить образование щелочных скоплений, что приводит к повышенной активности коррозионных процессов.
Однако, не все металлы реагируют с щелочью отрицательно. Например, железо и его сплавы в щелочной среде могут образовывать пленки оксида, которые защищают металл от дальнейшей коррозии. Еще одним металлом, обладающим повышенной стойкостью к щелочам, является нержавеющая сталь. Это объясняется наличием хрома в составе сплава, который образует пассивный слой, предохраняющий металл от коррозии.
При взаимодействии щелочи с алюминием, образующаяся оксидная пленка может выступать как защитная, так и разрушающая. Защитная пленка образуется при низкой концентрации щелочи и может быть стабильной. Однако, при высокой концентрации щелочи пленка разрушается, что способствует дальнейшей коррозии алюминия.
Итак, влияние щелочи на коррозию металлов зависит от многих факторов, включая концентрацию щелочи, времени взаимодействия и типа металла. Изучение этих взаимодействий позволяет более глубоко понять процессы коррозии и разработать методы защиты металлов от воздействия щелочных сред.
Металлы, не взаимодействующие с щелочью
Щелочь является химической субстанцией, которая обладает высокой щелочностью и обычно реагирует с различными веществами. Однако, есть некоторые металлы, которые не вступают во взаимодействие с щелочью.
Один из таких металлов - золото. Золото считается одним из самых стабильных металлов и не реагирует с щелочной средой. Оно сохраняет свою блеск и химические свойства даже при длительном контакте с щелочью.
Другим металлом, который не взаимодействует с щелочью, является платина. Платина обладает высокой устойчивостью к различным химическим реакциям и не реагирует с щелочными растворами. Это делает платину незаменимым материалом во многих промышленных и научных областях.
Также к металлам, которые не взаимодействуют с щелочью, относится серебро. Серебро обычно сохраняет свою яркость и химическую стабильность при контакте с щелочными растворами. Это свойство делает его ценным материалом для производства украшений и посуды.
В то же время, металлы, такие как алюминий или цинк, могут реагировать с щелочными растворами. Они могут образовывать газы или соли в результате химической реакции с щелочью. Поэтому при работе с металлами необходимо учитывать их химическую реакционную способность и принимать соответствующие меры предосторожности.
Таким образом, золото, платина и серебро являются металлами, которые не реагируют с щелочью и сохраняют свои химические свойства при контакте с ней. Они играют важную роль в различных областях промышленности и науки, благодаря своей устойчивости и надежности.
Выводы и практическое применение

Изучение взаимодействия металлов с щелочью позволяет получить важные выводы и найти практическое применение этого знания. Одним из основных выводов является то, что при контакте металлов с щелочью может происходить химическая реакция, в результате которой образуется соответствующее соединение. Например, при контакте железа с гидроксидом натрия (щелочью) может образоваться гидроксид железа и натрия.
Практическое применение знаний о взаимодействии металлов с щелочью находится, например, в процессе очистки поверхности металла перед нанесением защитного покрытия. Для удаления окислов и загрязнений применяются растворы щелочи, которые образуются при взаимодействии металла с щелочью. В результате химической реакции металлическая поверхность очищается от примесей и готовится к нанесению покрытия.
Еще одним практическим применением является использование реакции взаимодействия металлов с щелочью для получения энергии. Например, при реакции алюминия с щелочью выделяется водород, который можно использовать в качестве горючего для производства электроэнергии. Это позволяет использовать металлы, такие как алюминий, в качестве альтернативного источника энергии.
Таким образом, изучение взаимодействия металлов с щелочью имеет не только теоретическое, но и практическое значение. Результаты таких исследований могут быть применены в различных областях, от технологии до энергетики, и помочь в решении различных задач, связанных с металлами и их взаимодействием с щелочью.
Вопрос-ответ

Какие металлы взаимодействуют с щелочью?
Взаимодействие металлов с щелочью возможно с металлами, такими как литий, натрий, калий, рубидий и цезий. Эти металлы образуют соль и выделяются водород.
Каков механизм взаимодействия металлов с щелочью?
Взаимодействие металлов с щелочью происходит по реакции металла с водой. Металл реагирует с водой, образуя гидроксид металла и выделяя водородный газ. Гидроксид металла образует соль в случае взаимодействия с щелочью.
Какие вещества образуются при взаимодействии металлов с щелочью?
При взаимодействии металлов с щелочью образуются гидроксиды металлов и соответствующие соли. Например, при взаимодействии калия с щелочью образуется гидроксид калия (каустическая сода) и соль калия.
Возможно ли взаимодействие всех металлов с щелочью?
Нет, не все металлы могут взаимодействовать с щелочью. Только самые активные металлы, такие как литий, натрий, калий, рубидий и цезий, образуют реакцию с водой, образуя гидроксиды и соли. Остальные металлы не обладают достаточной активностью для такого взаимодействия.
Какие свойства имеют гидроксиды металлов, образующиеся при взаимодействии с щелочью?
Гидроксиды металлов, образующиеся при взаимодействии металлов с щелочью, обладают щелочными свойствами. Они растворяются в воде, образуя гидроксидные ион-пары, которые повышают pH раствора и делают его щелочным. Гидроксиды металлов также являются основаниями и могут реагировать с кислотами, образуя соли.
