Серная кислота (H2SO4) является одним из наиболее известных и широко используемых химических соединений. Она является сильным оксидирующим агентом и обладает рядом уникальных свойств, включая высокую кислотность и активность по отношению к различным веществам. Серная кислота реагирует с многими металлами в водных растворах, что приводит к образованию солей и выделению водорода.
Взаимодействие металлов с серной кислотой является химической реакцией окисления-восстановления. В результате этой реакции происходит передача электронов между металлом и серной кислотой. Металл окисляется, отдавая электроны, а серная кислота восстанавливается, получая электроны. Эта реакция часто сопровождается выделением водорода, который образуется в результате высвобождения протонов из серной кислоты.
Реакция серной кислоты с металлами может быть представлена следующим образом:
H2SO4 + M -> MSO4 + H2
Где M обозначает металл, а MSO4 - соль соответствующего металла. Эта реакция является экзотермической, то есть сопровождается выделением тепла.
Химические реакции серной кислоты с металлами имеют широкое применение в промышленности и лаборатории. Например, они используются для получения солей металлов, как процесс очистки металлических поверхностей или в процессе синтеза других соединений. Кроме того, эти реакции являются частью учебной программы студентов химических специальностей и помогают им лучше понять основы химии и принципы окисления-восстановления.
Механизм реакций серной кислоты с металлами
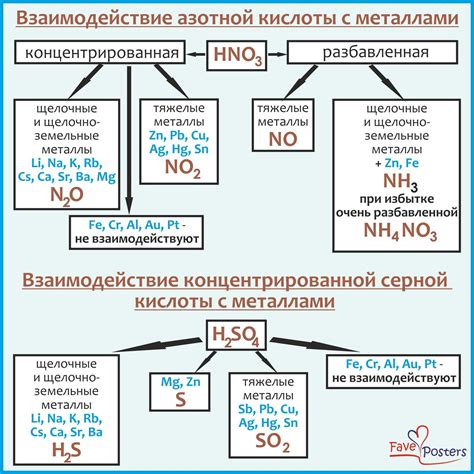
Реакции серной кислоты с металлами происходят в водных растворах, где серная кислота диссоциирует на ионы водорода и сульфатные ионы. Механизм таких реакций обычно предполагает начало с передачи протона от серной кислоты металлу.
Сначала металл вступает в контакт с серной кислотой, затем происходит диссоциация серной кислоты на ионы водорода и сульфатные ионы. Далее, ионы водорода и сульфатные ионы реагируют с поверхностью металла, образуя оксиды и сульфаты.
Процесс реакции может быть описан следующим образом: вначале серная кислота передает протон ионам металла, образуя соответствующий оксид или гидроксид металла и серную кислоту в сульфатной форме. Далее, сульфатная форма металла растворяется в воде и образует ионы металла и сульфатные ионы.
Следует отметить, что реакция серной кислоты с различными металлами может иметь немного разные характеристики. Например, сильно окисляющая серная кислота может реагировать с активными металлами, такими как натрий и калий, образуя взрывчатые соединения.
Таким образом, механизм реакций серной кислоты с металлами в водных растворах обусловлен диссоциацией серной кислоты и передачей протона от серной кислоты к металлу. Эти реакции могут приводить к образованию оксидов и гидроксидов металла в виде соединений с серной кислотой. Важно отметить, что реакция серной кислоты с металлами может различаться в зависимости от конкретных условий и свойств металла.
Водородная реакция металлов с серной кислотой

Водородная реакция — это химическая реакция, в результате которой образуется водород. Именно эта реакция наблюдается при взаимодействии металлов с серной кислотой.
Серная кислота (H2SO4) — это сильная минеральная кислота, которая активно реагирует с различными металлами. Реакция между металлами и серной кислотой протекает с образованием соли и выделением водорода.
Обычно водородная реакция металлов со серной кислотой идет по следующей схеме:
- Металл вступает в реакцию с серной кислотой, образуя соль и водородный ион (H+).
- Водородный ион отщепляется от кислоты и выделяется в виде газа.
- В результате образуется сульфат металла, который остается в растворе в виде соли.
Водородные реакции металлов с серной кислотой могут быть различных типов. Например, некоторые металлы, такие как железо (Fe) и цинк (Zn), способны производить высокую концентрацию газа водорода. Другие металлы, такие как медь (Cu) и серебро (Ag), реагируют с серной кислотой только при нагревании или в присутствии катализатора.
Водородная реакция металлов с серной кислотой имеет широкое применение в различных областях, включая производство водорода, очистку металлов от окисленных покрытий и получение различных химических продуктов.
Образование сульфатов металлов в растворе
Сульфаты металлов образуются при химических реакциях серной кислоты с различными металлами в водных растворах. В результате таких реакций серная кислота окисляется, а металлы редуцируются, образуя сульфаты.
Образование сульфатов металлов в растворе происходит путем реакции ионов металла с ионами серной кислоты. Водный раствор сульфата металла содержит положительно заряженные ионы металла и отрицательно заряженные ионы сульфата.
Сульфаты металлов имеют широкое применение в различных областях науки и промышленности. Они используются в производстве удобрений, красителей, лекарственных препаратов, химических реагентов и многих других продуктов. Они также широко применяются в аналитической химии для определения наличия и количества определенных металлов в растворах.
Некоторые сульфаты металлов обладают особыми свойствами. Например, сульфаты меди обычно образуют кристаллы синего или зеленого цвета, в то время как сульфаты железа могут иметь разные окраски в зависимости от степени окисления железа.
Таким образом, образование сульфатов металлов в растворе является важным процессом, который имеет значительное практическое применение и активно изучается в рамках химических исследований.
Влияние концентрации серной кислоты на скорость реакции
Скорость химической реакции между серной кислотой и металлами в водных растворах зависит от концентрации серной кислоты. При увеличении концентрации кислоты, скорость реакции обычно возрастает. Это происходит потому, что большая концентрация кислоты обеспечивает большую доступность реагентов и большее количество коллизий между частицами металла и частицами кислоты.
Увеличение концентрации серной кислоты приводит к увеличению количества коллизий между реагентами, что в свою очередь повышает вероятность успешного столкновения, обеспечивая более высокую скорость реакции. Этот эффект особенно заметен при низких концентрациях кислоты, когда количество доступных реагентов ограничено, и увеличение их количества стимулирует более интенсивное взаимодействие.
С другой стороны, при очень высоких концентрациях серной кислоты наличие многочисленных и интенсивных коллизий не всегда способствует увеличению скорости реакции. В таких условиях начинают играть роль и другие факторы, например, конкуренция реагентов за доступ к активным местам на поверхности металла, что может снижать скорость реакции на ранних этапах.
Таким образом, концентрация серной кислоты играет важную роль в определении скорости реакции с металлами в водных растворах. Увеличение концентрации кислоты обеспечивает более интенсивные и успешные коллизии между реагентами, что в конечном итоге приводит к повышению скорости химической реакции.
Термическое и химическое окисление металлов серной кислотой

Серная кислота (H2SO4) является мощным окислителем и способна реагировать с различными металлами, в результате чего происходит их окисление. Окисление металлов серной кислотой можно разделить на два типа: термическое и химическое окисление.
Термическое окисление металлов серной кислотой происходит при нагревании и характеризуется образованием оксидов металлов. Например, при нагревании железа (Fe) с серной кислотой происходит реакция, в результате которой образуется оксид железа (III) и выделяется сернистый газ:
2Fe + 3H2SO4 → Fe2(SO4)3 + 3H2S
Химическое окисление металлов серной кислотой происходит при контакте металлов с разбавленной серной кислотой в водном растворе. В результате такого окисления происходит выделение газов и образование солей металлов. Например, при реакции цинка (Zn) с разбавленной серной кислотой образуется сульфат цинка (ZnSO4) и выделяется водородный газ:
Zn + H2SO4 → ZnSO4 + H2
Таким образом, серная кислота может быть использована для термического и химического окисления различных металлов, что делает ее важным реагентом в химических и промышленных процессах.
Вопрос-ответ

Какие металлы могут реагировать с серной кислотой в водных растворах?
Серная кислота может реагировать с многими металлами, включая железо, алюминий, цинк, медь и свинец.
Что происходит при реакции серной кислоты со свинцом в водном растворе?
При реакции серной кислоты со свинцом водном растворе образуется сульфат свинца и выделяется газ - диоксид серы или сероводород.
Какие реакции могут происходить между серной кислотой и железом в водном растворе?
Серная кислота может окислять железо до двух степеней окисления: Fe(II) и Fe(III), образуя феррозоль и сульфат железа соответственно.
Чем отличается реакция серной кислоты с цинком от реакции с алюминием в водном растворе?
При реакции серной кислоты с цинком в водном растворе образуется сульфат цинка и выделяется водородный газ, а при реакции с алюминием образуется сульфат алюминия и выделяется газ диоксид серы.
