Шелочные металлы, такие как натрий, калий и литий, проявляют уникальные свойства при контакте с водой. Их реакция с водой является одной из наиболее изученных и важных химических реакций. В результате взаимодействия между металлом и водой происходят различные химические превращения, которые имеют как теоретическое, так и практическое значение.
Одной из особенностей реакции шелочных металлов с водой является выделение газа в виде пузырей. Это вызвано химическими превращениями, происходящими на поверхности металла и воды. При взаимодействии с водой шелочные металлы ионизируются, образуя ионы гидроксида и водорода. Такая реакция может протекать как медленно, так и быстро, в зависимости от концентрации металла, температуры и других факторов.
Применение реакции шелочных металлов с водой находит в различных областях науки и техники. Например, этот процесс используется для получения водорода в промышленном масштабе. Водород является одним из самых важных химических элементов и находит применение в производстве различных веществ, включая топливо для водородных топливных элементов и синтеза аммиака.
Исследование реакции шелочных металлов с водой также имеет большое значение для понимания основных принципов химии и химического равновесия. Это позволяет ученым разрабатывать новые методы синтеза и получения химических соединений, а также предсказывать и контролировать химические реакции.
В целом, изучение химических реакций шелочных металлов с водой дает возможность более глубокого понимания основных принципов химии и их применения в реальных условиях. Это позволяет совершенствовать процессы получения водорода и других веществ, а также разрабатывать новые материалы и технологии с использованием шелочных металлов.
Реактивность шелочных металлов

Шелочные металлы (литий, натрий, калий) являются очень реактивными элементами. Они легко взаимодействуют с водой, образуя гидроксиды и выделяя значительное количество водорода.
Стоит отметить, что реакция шелочных металлов с водой происходит весьма энергично и с выделением тепла. Это объясняется тем, что шелочные металлы обладают низким энергетическим барьером, что позволяет им быстро реагировать с водой.
Реакция шелочных металлов с водой является экзотермической и сопровождается выделением водорода и образованием гидроксидов шелочных металлов. Образовавшийся гидроксид шелочного металла растворяется в воде, образуя щелочное растворение, которое обладает щелочными свойствами.
Реактивность шелочных металлов обусловлена их электрохимическим потенциалом, который определяет их способность отдавать электроны в химических реакциях. Шелочные металлы имеют низкий электрохимический потенциал, что делает их активными веществами при взаимодействии с водой и другими веществами.
Процессы и характеристики реакции

Реакция шелочных металлов с водой является химическим процессом, который происходит при контакте соответствующих металлов с молекулами воды. Данная реакция часто сопровождается выделением газа и образованием щелочного раствора.
Шелочные металлы, такие как натрий, калий и литий, обладают атомными структурами, которые позволяют им реагировать с водой. При контакте с водой, атомы металлов отдают электроны, образуя положительные ионы. Эти ионы вступают в реакцию с водными молекулами, образуя гидроксидные ионы и выделяя молекулярный водород. Реакция протекает очень быстро и сопровождается значительным выделением тепла.
Особенностью реакции шелочных металлов с водой является высокая активность металлов, что позволяет им быстро и энергично вступать в реакцию. Это свойство широко используется в различных промышленных и научных процессах. Например, натрий и калий могут использоваться в качестве источников энергии в реактивных двигателях и реактивных системах. Также реакция шелочных металлов с водой используется для получения щелочных растворов, которые широко применяются в химической промышленности и в бытовых целях.
Реакция шелочных металлов с водой имеет ряд характеристик, которые влияют на ее процесс и результат. Например, чем выше активность металла, тем более энергичной будет реакция. Также важным фактором является концентрация металла и воды, которая может влиять на скорость реакции и образование продуктов. Температура также влияет на реакцию: при повышенной температуре процесс протекает быстрее, а при низкой температуре – медленнее.
Выделение водорода
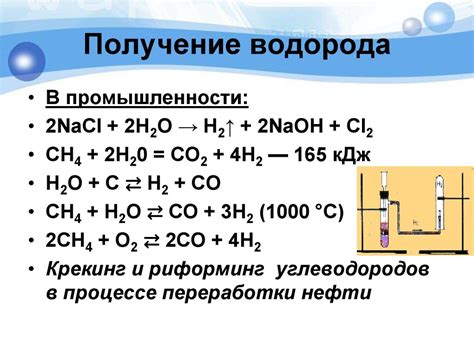
Выделение водорода является одним из основных процессов, связанных с химическими реакциями шелочных металлов с водой. Шелочные металлы, такие как натрий, калий и литий, обладают высокой активностью и способны реагировать с водой с образованием водорода и шелочи.
Химическое уравнение реакции выделения водорода выглядит следующим образом:
2M + 2H2O → 2MOH + H2
При этой реакции металл реагирует с молекулами воды, образуя гидроксид металла и освобождая молекулы водорода. Этот процесс часто сопровождается выделением газообразного водорода и образованием характерной пены или шлака на поверхности металла.
Выделение водорода является очень полезным процессом и находит свое применение в различных областях. Например, водород является важным сырьем для производства различных химических соединений, таких как аммиак, металлы при помощи реакции гидрогенизации, а также в качестве топлива для водородных топливных элементов. Также выделение водорода может быть использовано для получения чистого водорода из водной среды, что важно для решения проблем пищевой и запасной энергии в будущем.
Образование гидроксидов и гидроксидные растворы

Гидроксиды - это соединения, образующиеся в результате реакции шелочных металлов с водой. При взаимодействии металла и воды образуется соединение, состоящее из металла и гидроксила. Гидроксиды шелочных металлов являются щелочными соединениями и обладают высокой основностью.
Гидроксиды шелочных металлов обычно представляют собой кристаллические соединения, легко растворимые в воде. Растворы гидроксидов имеют щелочную реакцию и могут обладать различными свойствами: они могут быть едкими, образовывать щелочные растворы или быть ионами, взаимодействующими с другими соединениями.
Гидроксиды шелочных металлов имеют широкое применение в различных отраслях науки и техники. Они используются в производстве ионных аккумуляторов, отчего полученное решение становится очень щелочным. Белый порошок, как и многие производные гидроксида, используется в жировой промышленности, в производстве бумаги и целлюлозы, хозяйственных и канцелярских товаров.
Химические свойства гидроксидов шелочных металлов

Гидроксиды шелочных металлов обладают рядом химических свойств, которые делают их важными соединениями в различных областях науки и промышленности.
Во-первых, гидроксиды шелочных металлов являются щелочными растворами, то есть обладают высоким уровнем щелочности. Это связано с тем, что гидроксиды шелочных металлов образуют гидроксидные ионы (OH-), которые способны принимать протоны (H+) из водных растворов, тем самым повышая уровень рН.
Во-вторых, гидроксиды шелочных металлов обладают амфотерными свойствами. Это значит, что они могут реагировать и как основания, и как кислоты, взаимодействуя с кислотными и основными соединениями. Например, гидроксид натрия (NaOH) может реагировать с кислыми оксидами, образуя соль и воду.
Кроме того, гидроксиды шелочных металлов обладают высокой растворимостью в воде, что делает их хорошими растворителями и расплавами для различных веществ. Например, гидроксид натрия используется в лабораторных условиях для очистки и растворения различных соединений.
И, наконец, гидроксиды шелочных металлов широко применяются в различных процессах химической и промышленной технологии. Они используются в производстве мыла, стекла, бумаги, удобрений и других продуктов. Кроме того, они находят применение в аналитической химии, медицине и других областях науки.
Применение реакций с водой в промышленности
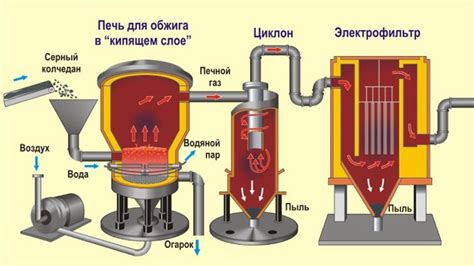
Реакции шелочных металлов с водой широко применяются в промышленности, благодаря своей высокой эффективности и экономичности. Одной из основных областей применения таких реакций является производство электроэнергии. Шелочные металлы, такие как натрий, калий и литий, используются в процессе работы термальных электростанций. Реакция шелочного металла с водой создает пар, который в свою очередь приводит в движение турбины, генерируя электрическую энергию.
В промышленности также активно используют реакцию шелочных металлов с водой для получения водорода. Водород является важным промышленным сырьем и используется в процессах производства аммиака, метанола и многих других химических соединений. Реакция шелочного металла с водой позволяет эффективно получать чистый водород, который затем может быть использован в различных отраслях промышленности.
Кроме того, реакции шелочных металлов с водой находят применение в процессах очистки и обеззараживания воды. Активный металл взаимодействует с водой, образуя гидроксид шелочного металла и выделяя водород. Гидроксид шелочного металла является сильным основанием, способным нейтрализовать кислотные загрязнители в воде и улучшить ее качество.
Таким образом, реакции шелочных металлов с водой нашли широкое применение в различных отраслях промышленности. Они используются как источник электрической энергии, метод получения водорода и средство очистки воды. Эти реакции являются важным компонентом современных технологий и способствуют развитию экономически и экологически эффективных процессов в промышленности.
Важность шелочных металлов в жизни человека

Шелочные металлы, такие как литий, натрий, калий, рубидий и цезий, играют важную роль в жизни человека и имеют широкое применение в различных сферах.
Литий используется в производстве аккумуляторов и лечении некоторых психических расстройств. Этот металл также может быть использован для снижения плотности алюминия, повышения прочности стекла и в производстве легких сплавов.
Натрий является одним из основных компонентов поваренной соли и необходим для поддержания нормального баланса воды в организме. Он также используется в производстве стекла, мыла, пластика и в других технических процессах.
Калий необходим для нормальной работы сердца, мышц и нервной системы. Он входит в состав удобрений, используется при производстве стекла и мыла, а также в фармацевтической промышленности.
Рубидий применяется в электронике, в частности в производстве полупроводников и лазерных приборов. Он также используется в научных исследованиях, включая создание часов и метеорологических инструментов.
Цезий широко используется в области ядерных исследований, производства изотопов для медицинских целей и радиоактивных источников энергии. Он также может быть использован в электронике и производстве оптических приборов.
В целом, шелочные металлы имеют огромное значение в различных отраслях промышленности, научных исследованиях и медицине, способствуя прогрессу и обеспечивая человечество необходимыми ресурсами и технологиями.
Вопрос-ответ

Какие металлы относятся к шелочным?
К шелочным металлам относятся литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr).
Как шелочные металлы реагируют с водой?
При реакции шелочных металлов с водой образуется соответствующий оксид металла и выделяется водород. Реакция происходит с выделением тепла и шелочные металлы обычно проявляются активностью при контакте с водой.
