Металлы - это особый класс элементов, которые обладают рядом уникальных свойств, таких как высокая теплопроводность, электропроводность и механическая прочность. Взаимодействие с металлами не только является основой для различных промышленных процессов, но и находит широкое применение в нашей повседневной жизни.
Одним из наиболее известных и практически важных примеров взаимодействия с металлами является ржавчина. Ржавчина - это процесс окисления металла под воздействием влаги и кислорода, при котором поверхность металла покрывается характерным ржавым налетом. Этот процесс является проблемой, когда речь идет о металлических конструкциях или предметах, которые подвергаются воздействию влаги и атмосферных условий.
Другим, более полезным примером взаимодействия с металлами является их способность проводить электрический ток. Благодаря этому свойству мы можем создавать электронные приборы и проводить электрическую энергию по цепи. Одним из наиболее распространенных и полезных металлов в этом отношении является медь. Медные провода используются повсеместно для передачи электричества в наших домах и промышленных сооружениях.
Взаимодействие с металлами также имеет место в химических реакциях. Например, металлы могут служить как катализаторы в различных химических процессах. Металлические катализаторы способствуют ускорению химических реакций, уменьшая энергию активации и повышая скорость реакции. Они применяются в промышленности для производства различных химических веществ, а также в автомобильной промышленности для очистки отработанных газов и снижения выбросов вредных веществ в окружающую среду.
Следует отметить, что взаимодействие с металлами является сложным и многогранным процессом, который требует глубокого понимания и изучения. Открытие новых способов взаимодействия с металлами может привести к разработке новых технологий и материалов, которые будут использоваться в различных областях, включая энергетику, промышленность, науку и медицину.
Что такое взаимодействие с металлами?

Взаимодействие с металлами – это явление, при котором металлы вступают во взаимодействие с различными веществами или средами, что приводит к изменению их свойств и химического состава. Металлы могут взаимодействовать с другими металлами, кислотами, основаниями, солями, газами, влагой и другими веществами.
Взаимодействие с металлами может происходить в различных условиях – при нормальных условиях температуры и давления, в процессе термической обработки, при воздействии электрического тока, в присутствии различных катализаторов и др.
В результате взаимодействия с металлами могут возникать различные процессы и явления, такие как окисление, восстановление, сплавление, растворение, осаждение и другие. Взаимодействие с металлами часто сопровождается изменением их физических и химических свойств, электропроводностью, магнитными свойствами и другими характеристиками.
Взаимодействие с металлами имеет огромное практическое значение. Металлы широко используются в различных отраслях промышленности – машиностроении, электротехнике, строительстве, химической промышленности и других. Изучение и понимание процессов взаимодействия с металлами позволяет разрабатывать новые материалы и технологии, улучшать свойства металлов и их соединений, повышать эффективность и качество производства.
Металлы и их химические свойства

Металлы - это класс элементов, обладающих рядом характерных химических свойств. Одной из основных характеристик металлов является их способность образовывать ионные соединения. Это связано с тем, что металлы имеют низкую электроотрицательность, что обуславливает их склонность отдавать электроны.
Металлы обычно обладают высокой теплопроводностью и электропроводностью. Это объясняется наличием свободных электронов в их кристаллической решетке, которые могут свободно передвигаться и переносить энергию или электрический заряд.
Металлы обычно образуют положительные ионы, которые имеют протонное число, равное заряду ядра и отсутствуют в электронной оболочке. Это свойство позволяет металлам формировать соли и металлические сплавы с другими элементами.
Некоторые металлы имеют высокую реакционную способность и способны реагировать с водой или кислотами, выделяя водород. Другие металлы могут реагировать с кислородом, образуя оксиды, которые могут быть как основными, так и кислотными.
Металлы могут проявлять различные магнитные свойства. Некоторые металлы, такие как железо, никель и кобальт, являются магнитными и обладают способностью притягиваться к магниту или образовывать магнитное поле.
Общая характеристика металлов включает их высокую пластичность и прочность. Металлы могут легко деформироваться путем образования дислокаций в своей кристаллической структуре, что делает их идеальными материалами для строительства и производства различных изделий.
Как металлы взаимодействуют с кислородом

Взаимодействие металлов с кислородом является одним из основных процессов, которые происходят при окислении металлов. Когда металлы вступают в контакт с кислородом, происходит окисление, в результате которого образуется оксид металла.
Оксиды металлов могут иметь различные свойства и использоваться в разных отраслях промышленности. Например, оксид железа (Fe2O3) используется для производства стали, а оксид алюминия (Al2O3) - для производства керамики.
В некоторых случаях взаимодействие металлов с кислородом может привести к нежелательным последствиям. Например, при окислении железа образуется ржавчина, которая является признаком коррозии металла. Для предотвращения коррозии часто применяются специальные покрытия или покрытие металла слоем другого металла.
Кроме того, взаимодействие металлов с кислородом может привести к образованию оксидных пленок на поверхности металла. Эти пленки могут защищать металл от дальнейшей окислительной реакции. Например, у алюминия образуется тонкая пленка оксида, которая защищает металл от дальнейшей коррозии.
Таким образом, взаимодействие металлов с кислородом играет важную роль в различных процессах, связанных с производством и эксплуатацией металлических изделий. Наблюдение и изучение этих процессов позволяет разрабатывать новые материалы и технологии, а также предотвращать нежелательные последствия, связанные с взаимодействием металлов и кислорода.
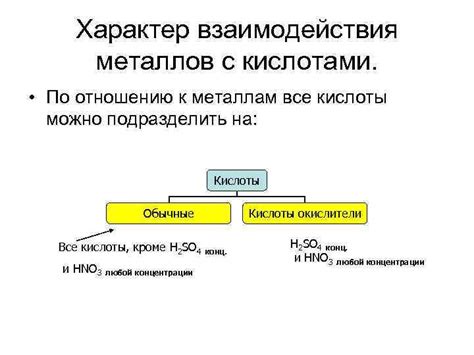
Взаимодействие металлов с кислотами

Металлы могут взаимодействовать с кислотами, образуя соли и выделяя гидроген. В процессе реакции между металлом и кислотой происходит обмен ионами, что приводит к изменению свойств обоих веществ.
Взаимодействие металлов с кислотами может происходить различными способами. Например, активные металлы, такие как натрий, калий и литий, реагируют с кислотами с выделением гидрогена. При этом образуются соли металлов, например, хлорид натрия (NaCl) или сульфат калия (K2SO4).
Неактивные металлы, такие как железо или алюминий, также могут реагировать с кислотами, но процесс может быть более сложным. Взаимодействие железа или алюминия с кислотами обычно приводит к образованию солей металлов и выделению гидрогена, но иногда может требоваться активация металла, например, при использовании различных катализаторов.
Реакция между металлом и кислотой может проходить с разной интенсивностью в зависимости от свойств обоих веществ. Например, сильные кислоты, такие как соляная (HCl) или серная (H2SO4), могут быстро реагировать с металлами, в то время как более слабые кислоты, например, уксусная (CH3COOH) или аспириновая (C9H8O4), могут взаимодействовать с металлами более медленно.
Металлы в реакциях с щелочами
Металлы могут взаимодействовать с щелочными растворами, образуя соответствующие соли и выделяя молекулярный водород. При этом исходный металл оказывается окислен, а гидроксид щелочи — восстановлен. Например, при реакции натрия с водой образуется гидроксид натрия и выделяется водородный газ:
- Реакция металла с водой:
- Реакция металла с гидроксидом щелочи:
2Na + 2H2O → 2NaOH + H2
2Na + 2NaOH → 2Na2О + H2
При взаимодействии алюминия с щелочами образуется алюминат натрия и выделяется водородный газ:
- Реакция алюминия с водой:
- Реакция алюминия с гидроксидом натрия:
2Al + 6H2O → 2Al(OH)3 + 3H2
2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2
Таким образом, реакции металлов с щелочами являются реакциями окисления-восстановления и могут протекать с выделением газа, что является одним из характерных признаков таких реакций.
Электрохимические реакции с участием металлов

Электрохимические реакции с участием металлов являются основой для многих промышленных и научных процессов. Они основаны на взаимодействии металлов с растворами электролитов или другими металлами, при котором происходит передача электронов и образование ионов.
Одним из известных примеров электрохимической реакции с участием металлов является коррозия. Коррозия возникает при взаимодействии металла с окружающей средой, особенно с водой и кислородом. В результате этой реакции на поверхности металла образуется оксид или гидрооксид, который является неустойчивым и далее разрушается.
Другим примером электрохимической реакции с участием металлов является гальваническая электрохимическая ячейка. В такой системе два различных металла погружены в растворы электролитов и соединены проводником. Происходит течение электрического тока через проводник, при этом один металл окисляется, а другой восстанавливается.
Также электрохимические реакции с участием металлов применяются в процессах электролиза. В этом случае приложенное электрическое поле вызывает перемещение ионов металла в растворе к электроду. На катоде происходит восстановление металла, а на аноде его окисление. Электролиз используется для получения чистых металлов и в процессах электрохимической обработки поверхности металлов.
Важные примеры взаимодействия металлов в повседневной жизни
Металлы играют важную роль во многих аспектах нашей повседневной жизни. Они используются в различных отраслях промышленности, строительстве, транспорте и многих других сферах. Рассмотрим несколько примеров взаимодействия металлов, которые являются особенно значимыми.
Автомобильная промышленность: В производстве автомобилей металлы применяются повсюду - от кузова до двигателя. Каркас автомобиля, бамперы, диски колес, двигательные детали, системы охлаждения - все это выполнено из различных металлических сплавов. Благодаря своим свойствам, металлы обеспечивают прочность, устойчивость и надежность автомобилей.
Электроника: Металлы играют ключевую роль в производстве электронных устройств. Многие компоненты, такие как провода, контакты, чипы, печатные платы, изготавливаются из металлических материалов. Благодаря своей электропроводности и прочности, металлы обеспечивают эффективную работу и долговечность электроники.
Медицина: Металлы широко применяются в медицине. Например, титановые имплантаты используются при замене суставов или восстановлении костей. Стерилизация медицинского оборудования часто осуществляется при помощи металлических инструментов и оборудования. Кроме того, металлы используются в изготовлении медицинских приборов, стентов, зубных протезов и других медицинских изделий.
Строительство: Металлы являются неотъемлемой частью строительных процессов. Они применяются при возведении зданий, мостов, туннелей и других инфраструктурных объектов. Стальные конструкции обеспечивают прочность и устойчивость сооружений. Кроме того, металлы используются для производства труб, кабельных систем, систем отопления и вентиляции, а также для электропроводки.
Пищевая промышленность: Металлы используются в пищевой промышленности для производства и хранения продуктов. Нержавеющая сталь и алюминий позволяют сохранять качество и безопасность пищевых продуктов. Консервные банки, кастрюли, плиты, посуда, холодильные камеры - все это изготовлено из металлических материалов.
Это лишь некоторые примеры взаимодействия металлов в повседневной жизни. Металлы играют важную роль в различных областях, обеспечивая прочность, надежность и эффективность различных изделий и процессов.
Вопрос-ответ

Какие металлы взаимодействуют с кислородом?
Металлы, такие как магний, алюминий и цинк, могут реагировать с кислородом воздуха и образовывать оксиды, например, оксид магния (MgO), оксид алюминия (Al2O3) и оксид цинка (ZnO).
Что происходит, когда металл взаимодействует с кислотой?
Когда металл взаимодействует с кислотой, обычно происходит химическая реакция, в результате которой выделяется водород. Например, железо может реагировать с соляной кислотой и образовывать соль железа (II) и водородный газ: Fe + 2HCl -> FeCl2 + H2.
Какие металлы реагируют с водой?
Некоторые металлы, такие как натрий, калий и кальций, реагируют с водой и выделяют водородный газ. Например, натрий реагирует с водой по следующему уравнению: 2Na + 2H2O -> 2NaOH + H2.
Как металлы взаимодействуют с кислородом в растворах?
Некоторые металлы могут реагировать с кислородом в водных растворах и образовывать гидроксиды. Например, натрий реагирует с кислородом в воде и образует гидроксид натрия: 4Na + O2 + 2H2O -> 4NaOH.
Что происходит, когда металл взаимодействует с карбонатами?
Когда металл взаимодействует с карбонатами, обычно происходит реакция образования соли, углекислого газа и воды. Например, при взаимодействии натрия с карбонатом натрия образуется соль (натриевый карбонат), углекислый газ и вода: 2Na + CO3 -> Na2CO3 + CO2 + H2O.
