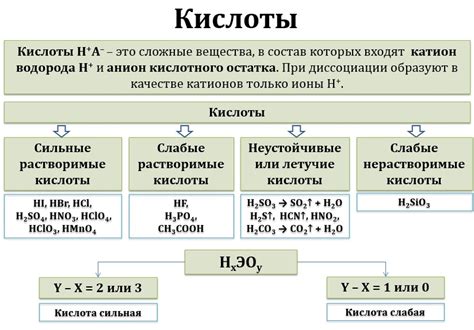
Разбавленная азотная кислота (HNO3) - важный химический реагент, широко применяемый в различных отраслях промышленности и лабораторной практике. Ее взаимодействие с металлами является интересным исследовательским объектом, поскольку может привести к образованию различных соединений, включая оксиды.
Магний (Mg) и цинк (Zn) являются химическими элементами, которые реагируют с азотной кислотой. В дальнейшем, при дальнейшем взаимодействии этих металлов с разбавленной азотной кислотой, возможно образование соответствующих оксидов.
Магний реагирует с азотной кислотой, образуя нитрит магния (Mg(NO2)2), а также оксид азота (NO) и воду (H2O). Оксид азота образуется в результате диспропорционирования азотной кислоты, при котором основание и окислительное вещество превращаются в стабильные формы.
Цинк также реагирует с разбавленной азотной кислотой, образуя нитрат цинка (Zn(NO3)2). Данное соединение является сильной окислительной реагентом и может быть использовано в химических реакциях для окисления других веществ.
Исследование взаимодействия разбавленной азотной кислоты с металлами Mg и Zn: возможное образование оксидов

Исследование проводится с целью изучения реакций взаимодействия разбавленной азотной кислоты с металлами магнием (Mg) и цинком (Zn) и возможного образования оксидов этих металлов.
Азотная кислота – химическое соединение, которое в малых концентрациях сильно окисляет и разрушает органические и неорганические вещества. Взаимодействие разбавленной азотной кислоты с металлами может привести к образованию соответствующих оксидов.
Магний и цинк – это металлы, которые активно взаимодействуют с кислотами. При вступлении в реакцию с разбавленной азотной кислотой, магний и цинк могут образовывать соответствующие оксиды – оксид магния (MgO) и оксид цинка (ZnO).
Образование оксидов магния и цинка при взаимодействии с азотной кислотой может иметь важное практическое значение. Оксиды этих металлов широко используются в различных областях, включая медицину, строительство, производство керамики и электроники.
Для проведения исследования необходимо определить условия взаимодействия разбавленной азотной кислоты с металлами Mg и Zn, а также изучить образование и свойства полученных оксидов. Результаты исследования могут быть полезными для развития новых методов синтеза оксидов магния и цинка, а также для понимания химических процессов, происходящих при взаимодействии металлов с кислотами.
Роль азотной кислоты в химических реакциях
Азотная кислота (HNO3) играет важную роль во многих химических реакциях. Ее химические свойства позволяют использовать ее в качестве окислителя или донора азота. Взаимодействие азотной кислоты с другими веществами может привести к образованию новых соединений и изменению их химических свойств.
Окисление органических веществ: Азотная кислота может быть использована в качестве сильного окислителя для окисления органических веществ. При этом оказывается важной роль азота, который переходит в нитратные и нитрозные группы. Такие реакции широко используются в органическом синтезе для получения различных соединений.
Образование нитратов: Взаимодействие азотной кислоты с металлами может привести к образованию нитратов. Например, реакция между азотной кислотой и магнием (Mg) приводит к образованию нитрата магния (Mg(NO3)2). Нитраты являются важными соединениями, используемыми в промышленности и сельском хозяйстве.
Нейтрализация: Азотная кислота может быть нейтрализована щелочами или основаниями, такими как щелочная земля или гидроксиды. Эти реакции приводят к образованию солей. Например, нейтрализация азотной кислоты гидроксидом натрия приводит к образованию нитрата натрия и воды. Такие реакции имеют большое практическое значение, так как нитраты широко используются в производстве удобрений и взрывчатых веществ.
Формирование оксидов: При взаимодействии азотной кислоты с металлами, такими как магний (Mg) и цинк (Zn), может происходить образование соответствующих оксидов. Например, с магнием образуется оксид магния (MgO), а с цинком - оксид цинка (ZnO). Оксиды металлов обладают различными свойствами и могут использоваться в различных областях, включая производство стекла, качественный анализ и электрохимические процессы.
Влияние разбавления азотной кислоты на процесс взаимодействия

Разбавление азотной кислоты является важным фактором, влияющим на процесс взаимодействия этой кислоты с металлами Mg и Zn. При разбавлении азотной кислоты ее концентрация уменьшается, что может сказаться на скорости и эффективности реакции.
Взаимодействие разбавленной азотной кислоты с металлами Mg и Zn происходит с образованием соответствующих оксидов. Оксиды металлов обладают различными свойствами, которые могут быть полезными для различных промышленных процессов.
Разбавление азотной кислоты может повлиять на процесс образования оксидов, так как скорость реакции зависит от концентрации реагентов. Более разбавленная кислота может привести к медленному образованию оксидов, тогда как более концентрированная кислота может способствовать более быстрому образованию оксидов.
Кроме того, разбавление азотной кислоты может изменить свойства образовавшихся оксидов. Концентрация кислоты может влиять на степень окисления металлов и их свойства, такие как температура плавления и термическая стабильность оксидов.
Взаимодействие азотной кислоты с металлом Mg

Металл магний (Mg) может реагировать с азотной кислотой (HNO3), что приводит к образованию оксида магния (MgO) и оксидов азота. Эта реакция является одной из основных химических реакций, которые возникают при взаимодействии металлов с кислотами.
Взаимодействие азотной кислоты с металлом Mg происходит по следующей схеме: Mg + 2HNO3 → Mg(NO3)2 + H2O. В результате реакции образуется соль нитрата магния и вода.
Реакция взаимодействия азотной кислоты с металлом Mg является эндотермической, то есть сопровождается поглощением тепла. Образование оксида магния и оксидов азота происходит в результате разложения кислоты под воздействием металла.
Выделение газовых продуктов (оксидов азота) при реакции магния с азотной кислотой обусловлено разложением азотной кислоты при повышенной температуре. Оксиды азота являются одними из основных продуктов реакции и имеют сильный запах.
Оксид магния, образующийся при реакции, является белым порошком с химической формулой MgO. Он обладает высокой температурной стабильностью и широко используется в различных отраслях промышленности, в том числе в производстве огнеупорных материалов и стекол.
Образование оксидов при взаимодействии азотной кислоты с металлом Mg

При взаимодействии азотной кислоты с металлом Мg возможно образование различных оксидов. Азотная кислота, также известная как азотная кислота, является сильным окислителем и имеет способность реагировать с различными металлами. Металл Мg является одним из таких металлов, которые подвергаются окислительной реакции при взаимодействии с азотной кислотой.
При взаимодействии азотной кислоты с металлом Мg образуются оксиды магния (MgO). Оксид магния является белым кристаллическим веществом, которое образуется в результате окисления металла Мg. Реакция между азотной кислотой и металлом Мg происходит следующим образом: азотная кислота окисляет металл, образуя оксид магния и выделяя диоксид азота.
Образование оксидов при взаимодействии азотной кислоты с металлом Мg является энергетически выгодным процессом, так как азотная кислота обладает сильной окислительной активностью. Это обусловлено наличием в молекуле азотной кислоты атома азота с высокой электроотрицательностью, который притягивает электроны от металла Мg и тем самым способствует образованию оксида магния.
Взаимодействие азотной кислоты с металлом Zn

Азотная кислота (HNO3) является сильной органической кислотой, которая способна взаимодействовать с металлами. Одним из таких металлов является цинк (Zn).
При контакте азотной кислоты с металлом Zn происходит реакция, в результате которой могут образовываться различные соединения. Основной продукт реакции - нитрат цинка (Zn(NO3)2), который образуется при окислении цинка азотной кислотой.
Реакция взаимодействия азотной кислоты с цинком протекает с выделением газа. Это связано с образованием азотного диоксида (NO2), который является коричневым газом и имеет характерный запах. Образующийся газ увеличивает объем системы и оказывает давление на окружающую среду.
Помимо нитрата цинка, в результате взаимодействия азотной кислоты с цинком могут образовываться другие оксиды и соединения. Например, оксид цинка (ZnO) может образовываться в результате дальнейшего окисления цинка нитратом цинка. Оксид цинка является белым порошком и обладает свойствами полупроводника.
Таким образом, взаимодействие азотной кислоты с металлом Zn приводит к образованию нитрата цинка и других соединений, таких как оксид цинка. Эти реакции имеют практическое значение при производстве химических соединений и в различных промышленных процессах.
Влияние разбавления азотной кислоты на процесс образования оксидов с металлом Zn
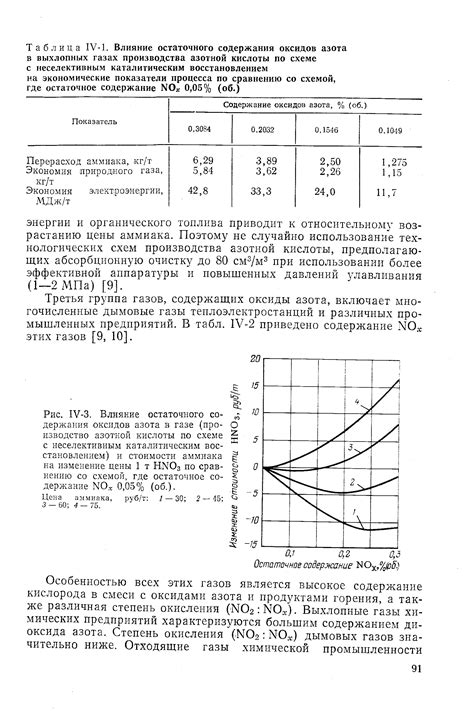
Азотная кислота является сильным оксидирующим агентом, способным реагировать с многими металлами. Процесс образования оксидов металла Zn при взаимодействии с разбавленной азотной кислотой подвержен влиянию степени ее разбавления.
При разбавлении азотной кислоты происходит увеличение количества молекул реагента, что способствует усилению оксидации металла Zn. В результате образуются оксиды, которые могут иметь различные свойства и структуру в зависимости от концентрации азотной кислоты.
С помощью разных методов исследования, таких как физическая химия и рентгеноструктурный анализ, можно определить структуру и химический состав образовавшихся оксидов с металлом Zn. Эта информация позволяет изучить влияние концентрации азотной кислоты на процесс образования оксидов.
С увеличением концентрации разбавленной азотной кислоты происходит активация процесса оксидации металла Zn. Это связано с увеличением числа активных центров оксидации и повышением скорости реакции. При низкой концентрации кислоты происходит более медленное образование оксидов.
Таким образом, разбавление азотной кислоты оказывает существенное влияние на процесс образования оксидов с металлом Zn. Концентрация кислоты определяет скорость реакции и свойства образовавшихся оксидов. Дальнейшие исследования в этой области помогут более полно понять механизм этой реакции и оптимизировать процесс с точки зрения практического использования.
Характеристика образовавшихся оксидов при взаимодействии с металлами

Взаимодействие разбавленной азотной кислоты с металлами Mg и Zn может привести к образованию оксидов этих металлов. Оксид магния (MgO) и оксид цинка (ZnO) обладают отличными характеристиками и находят широкое применение в различных отраслях промышленности.
Оксид магния (MgO) является твердым белым веществом, без запаха и вкуса. Он обладает высокой температурной стабильностью, с выдерживает температуры до 2800 °C. MgO не растворим в воде, но растворяется в кислотах, аммиаке и органических растворителях. Он имеет высокую теплопроводность и применяется в производстве огнеупорных материалов, керамики, стекловолокна и других продуктов.
Оксид цинка (ZnO) является белым порошком или кристаллами. Он обладает полупроводниковыми свойствами и используется в электронике для изготовления полупроводниковых компонентов. ZnO не растворим в воде, но растворяется в кислотах и щелочах. Он также обладает антисептическими и солнцезащитными свойствами, поэтому находит применение в косметической и фармацевтической промышленности.
Возможность образования оксидов при взаимодействии разбавленной азотной кислоты с металлами Mg и Zn открывает широкие перспективы для их применения в различных отраслях промышленности и научных исследованиях.
Вопрос-ответ

Что такое разбавленная азотная кислота?
Разбавленная азотная кислота - это раствор азотной кислоты, разведенный в воде. Обычно разбавляют концентрированную азотную кислоту для получения раствора с определенной концентрацией.
Каково взаимодействие разбавленной азотной кислоты с металлами Mg и Zn?
Разбавленная азотная кислота может реагировать с металлами Mg и Zn, образуя соответствующие оксиды. Взаимодействие происходит следующим образом: азотная кислота окисляет металлы, образуя соответствующие ионы металла и выделяя газообразный оксид азота. Реакция с металлом Mg приводит к образованию оксида магния (MgO), а с металлом Zn - оксида цинка (ZnO).
