Реакция металлов с разбавленной азотной кислотой является одной из наиболее интересных и широко изученных химических реакций. Металлы, такие как медь, железо и цинк, проявляют различные степени активности взаимодействия с азотной кислотой, что зависит от их электрохимических свойств и структуры.
Реакция металлов с азотной кислотой приводит к выделению двух основных продуктов - оксида азота и солей металлов. Оксид азота, образующийся в результате реакции, представляет собой газообразное вещество с характерным запахом и является компонентом атмосферного загрязнения.
В зависимости от своей активности, металлы могут реагировать с азотной кислотой, образуя различные продукты. Например, реакция меди с азотной кислотой приводит к образованию синего раствора сульфата меди. Железо, в свою очередь, образует растворные комплексы с азотной кислотой, а цинк приводит к образованию хлорида цинка и оксида азота.
Исследование реакции металлов с азотной кислотой имеет практическую значимость как наука, так и для промышленности. Эта реакция широко применяется в процессе производства удобрений, при создании коррозионностойких материалов и в других химических процессах. Каждая реакция с металлом обладает уникальными свойствами и является объектом изучения для многих специалистов в области химии и материаловедения.
Реакция металлов с азотной кислотой
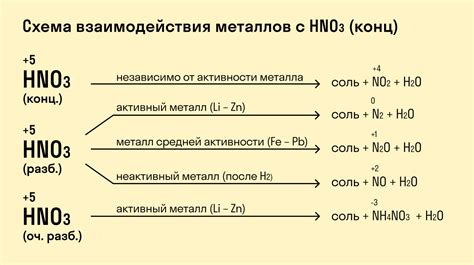
Азотная кислота представляет собой кислотное соединение, которое может проявлять свои реакционные свойства при взаимодействии с различными металлами. Эти реакции протекают с образованием соответствующих солей и выделением газов.
Например, знакомый многим металл - медь, может реагировать с азотной кислотой. При этом образуется соль - нитрат меди и выделяется оксид азота. Реакция можно представить как:
3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O
Также азотная кислота может реагировать с алюминием. В результате этой реакции образуется соль - нитрат алюминия и выделяется аммиак. Реакцию можно описать как:
2Al + 6HNO3 → 2Al(NO3)3 + 3NH3 + 3H2O
Реакция металлов с азотной кислотой может протекать различными способами в зависимости от свойств металла и условий проведения эксперимента. Например, реакция цинка с азотной кислотой может приводить к образованию соли - нитрата цинка и освобождению азота. Реакцию можно записать как:
Zn + 2HNO3 → Zn(NO3)2 + H2O + 2NO
Таким образом, реакция металлов с азотной кислотой является важным процессом химической взаимодействия, который может использоваться как в лабораторных условиях, так и в промышленности.
Какие металлы реагируют с разбавленной азотной кислотой
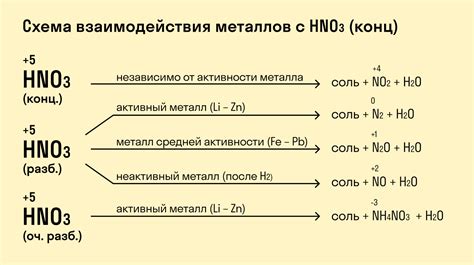
Металлы, реагирующие с разбавленной азотной кислотой – это вещества, которые взаимодействуют с этой кислотой, образуя соли и выделяя газы.
Одним из таких металлов является железо, которое при контакте с разбавленной азотной кислотой образует соль - нитрат железа(II) и выделяет округлые, коричневые газы с запахом аммиака.
Еще одним металлом, реагирующим с разбавленной азотной кислотой, является медь. При взаимодействии меди с азотной кислотой образуется нитрат меди(II) и выделяются газы, имеющие зеленоватый оттенок.
Алюминий также реагирует с разбавленной азотной кислотой. В результате получается нитрат алюминия, а изначальный металл растворяется, выделяяся газы с ярким белым дымом.
Таким образом, железо, медь и алюминий – это лишь несколько примеров металлов, которые реагируют с разбавленной азотной кислотой, образуя соли и выделяя газы. Такие реакции могут использоваться в химических экспериментах и процессах, а также иметь практическое значение в различных отраслях промышленности.
Влияние концентрации азотной кислоты на реакцию с металлами

Азотная кислота (HNO3) является сильным окислителем и может реагировать с различными металлами, образуя соответствующие соли и выделяя оксиды азота.
Одним из важных факторов, влияющих на реакцию азотной кислоты с металлами, является концентрация кислоты. Чем выше концентрация азотной кислоты, тем более интенсивной и быстрой будет протекать реакция с металлом.
Высокая концентрация азотной кислоты обеспечивает большее количество ионов H+ и NO3- в реакционной среде, что способствует ускорению реакции окисления металла. Также высокая концентрация кислоты позволяет преодолеть защитно-пассивную пленку, образующуюся на поверхности металла.
С ростом концентрации азотной кислоты увеличивается количество выделяющихся оксидов азота, что делает реакцию более заметной и интенсивной. При низкой концентрации кислоты реакция может быть менее явной и протекать медленнее.
Однако следует отметить, что слишком высокая концентрация азотной кислоты может привести к сильному коррозионному воздействию на металл, что может привести к его разрушению. Поэтому необходимо подбирать оптимальную концентрацию азотной кислоты в зависимости от типа и свойств металла, с которым будет проводиться реакция.
Причины реакции металлов с азотной кислотой
Реакция металлов с разбавленной азотной кислотой является одной из самых распространенных химических реакций в химии неметаллов. Прямое воздействие азотной кислоты на металлы приводит к образованию солей и выделению газа, в основном оксида азота.
Главной причиной реакции металлов с азотной кислотой является высокая химическая активность азотной кислоты и электролитические свойства металлов. Азотная кислота является сильным окислителем, способным окислять вещества, в том числе и металлы. Контакт металла с азотной кислотой приводит к передаче электронов между ними, что приводит к образованию солей металлов и выделению электронафеозера металлов.
Реакция металлов с азотной кислотой также обусловлена наличием свободных ионов в растворе азотной кислоты. Эти ионы образуются в результате диссоциации азотной кислоты. Когда металл вступает в реакцию с азотной кислотой, свободные ионы азотной кислоты притягиваются к поверхности металла и участвуют в окислительно-восстановительной реакции.
Более активные металлы, такие как натрий, калий и магний, реагируют с азотной кислотой более интенсивно, поскольку они имеют более низкую электроотрицательность и более низкую энергию ионизации. В результате реакции металла с азотной кислотой образуются соответствующие нитраты металлов, которые являются солями азотной кислоты.
Применение реакции металлов с разбавленной азотной кислотой
Реакция металлов с разбавленной азотной кислотой широко применяется в различных областях науки и промышленности. Эта реакция позволяет получать азотные соединения металлов, которые в свою очередь могут быть использованы в различных процессах.
Применение реакции металлов с разбавленной азотной кислотой находит свое применение в химическом производстве. Полученные азотные соединения металлов часто используются как катализаторы или компоненты при синтезе различных органических или неорганических соединений. Также эти соединения могут быть использованы в производстве удобрений и пестицидов.
Кроме того, реакция металлов с разбавленной азотной кислотой находит применение в аналитической химии. С ее помощью можно определить наличие или отсутствие определенного металла в образце. Азотные соединения, образующиеся при реакции, могут быть характеризованы различными методами анализа, такими как спектроскопия или хроматография.
Благодаря своим химическим свойствам и широкому спектру применения, реакция металлов с разбавленной азотной кислотой остается одной из важных и полезных реакций в современной науке и промышленности. Эта реакция продолжает совершенствоваться и находит новые области применения, внося свой вклад в развитие науки и технологий.
Вопрос-ответ

Какие металлы могут реагировать с разбавленной азотной кислотой?
Металлы, которые могут реагировать с разбавленной азотной кислотой, включают магний (Mg), алюминий (Al), цинк (Zn) и железо (Fe).
Что происходит при реакции металлов с разбавленной азотной кислотой?
При реакции металлов с разбавленной азотной кислотой происходит окислительно-восстановительная реакция, в результате которой образуется соответствующий нитрат металла и выделяется диоксид азота и водород.
Почему металлы реагируют с разбавленной азотной кислотой?
Металлы реагируют с разбавленной азотной кислотой из-за их способности отдавать электроны. Разбавленная азотная кислота является сильным окислителем и способна окислить металлы, получив от них электроны.
Какие факторы влияют на скорость реакции металлов с разбавленной азотной кислотой?
Скорость реакции металлов с разбавленной азотной кислотой зависит от различных факторов, включая концентрацию азотной кислоты, температуру, поверхность металла, наличие катализаторов, ионную силу раствора и др.
Какой общий узор можно наблюдать при реакции металлов с разбавленной азотной кислотой?
В общем случае, при реакции металлов с разбавленной азотной кислотой можно наблюдать эффервесценцию (выделение пузырьков газа), изменение цвета раствора, выделение красных или коричневых паров и т.д.
