Металлы - это группа химических элементов, которые имеют отличительные физические и химические свойства, такие как высокая проводимость электричества и тепла, обычно твердая или жидкая форма при комнатной температуре, и способность образовывать положительные ионы. В природе металлы часто встречаются в виде оксидов, которые образуются в результате реакции с кислородом.
Взаимодействие металлов с оксидами имеет свои особенности. Когда металл вступает в реакцию с оксидом, он обычно окисляется, т.е. его атомы теряют электроны, становясь положительными ионами. При этом оксид снижается, забирая электроны и превращаясь в металлическую форму. Это типичная реакция окисления-восстановления, которая играет важную роль в химии металлов.
Примером взаимодействия металла с оксидом является реакция алюминия с кислородом. Алюминий является одним из самых распространенных металлов на Земле и образует оксид алюминия (Al2O3). При нагревании алюминий реагирует с кислородом воздуха, окисляется и образует оксид. Эта реакция является экзотермической и сопровождается выделением большого количества тепла.
Взаимодействие металлов с оксидами играет важную роль в промышленности и технологии. Одним из наиболее известных примеров является процесс рафинирования железной руды для получения чистого железа. В этом процессе оксид железа (Fe2O3) вступает в реакцию с углеродом, который выступает в качестве восстановителя. В результате реакции оксид превращается в металл, а углерод окисляется, образуя углекислый газ (CO2).
Взаимодействие простых веществ металлов с оксидами имеет широкий спектр применений в науке и промышленности и является основой для многих химических реакций. Изучение этих реакций позволяет углубить наше понимание о химических свойствах металлов и способах их использования в различных отраслях промышленности.
Металлы и оксиды: основы взаимодействия
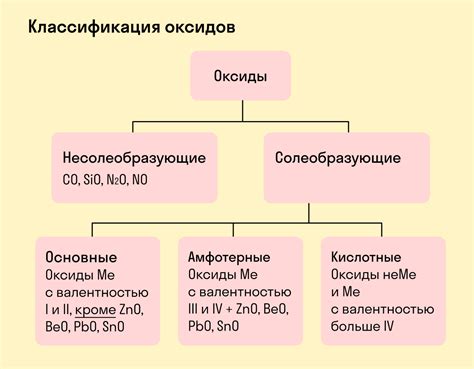
Металлы – это элементы, характеризующиеся высокой тепло- и электропроводностью, пластичностью и блестящей поверхностью. Оксиды – это химические соединения, образующиеся при взаимодействии металлов с кислородом. Взаимодействие металлов с оксидами является важным процессом, который может приводить к образованию различных соединений и изменению свойств исходных веществ.
Основой взаимодействия металлов с оксидами является окислительно-восстановительный процесс. Металл вступает в реакцию с кислородом, окисляется и образует оксид, а кислород восстанавливается. Реакция может протекать как с образованием металлического оксида, так и с образованием соли металла и кислорода.
Примером такого взаимодействия является реакция железа с кислородом из воздуха. При нагревании железа в присутствии кислорода образуется двуокись железа, которая проявляет себя в виде темно-красной порошковидной массы. Этот процесс называется ржавлением железа и приводит к изменению его свойств и возможной разрушительной коррозии.
Взаимодействие металлов с оксидами может иметь различные последствия, включая изменение цвета, структуры и свойств материала. Эти процессы широко используются в различных областях, начиная от металлургии и производства сплавов, и заканчивая применением оксидных покрытий в электронике и нанотехнологиях. Понимание основ взаимодействия металлов с оксидами позволяет контролировать и оптимизировать эти процессы в различных приложениях.
Реакция металлов с оксидами: что происходит?

Реакция металлов с оксидами представляет собой химическую реакцию, которая происходит при взаимодействии металлов с соответствующими оксидами. В результате этой реакции образуются новые вещества - металлические соединения.
В процессе реакции металлов с оксидами происходит термическое разложение оксида, при котором металл выделяет кислород и образует новое соединение. Обычно при этом происходит окисление металла и снижение оксида.
Примером реакции металла с оксидом является реакция алюминия с оксидом железа: 2Al + Fe2O3 → 2Fe + Al2O3. При этой реакции алюминий отдает кислород и окисляется, а железо получает кислород и восстанавливается.
Реакция металлов с оксидами является важным химическим процессом, который находит применение в различных областях, включая металлургию, производство материалов и энергетической технике. Этот процесс является основой для получения металлических соединений и исследования свойств веществ.
Примеры взаимодействия металлов с оксидами

1. Взаимодействие цинка с оксидом железа
При взаимодействии цинка с оксидом железа происходит реакция диспропорционирования. Цинк реагирует с оксидом железа в кислой среде, образуя цинковые и железные соединения. Реакция представляет собой окислительно-восстановительный процесс, при котором цинк восстанавливается, а железо окисляется.
2. Взаимодействие меди с оксидом свинца
Медь реагирует с оксидом свинца при нагревании, образуя соединение меди и свинец. Реакция протекает при высоких температурах и идет в направлении образования более стабильного соединения. В результате образуется медно-свинцовый сплав, который обладает хорошей пластичностью и применяется в металлургии и электротехнике.
3. Взаимодействие алюминия с оксидом магния
При нагревании алюминия с оксидом магния происходит реакция образования магния и алюминия. Алюминий является сильным восстановителем, поэтому он восстанавливает оксид магния до элементарного магния. При этом алюминий окисляется до трехвалентного состояния. Реакция протекает с выделением большого количества тепла и широко применяется в промышленности.
4. Взаимодействие никеля с оксидом никеля
Взаимодействие никеля с оксидом никеля является примером реакции восстановления. При нагревании происходит реакция образования никеля и оксида никеля. Никель восстанавливает оксид никеля до металлического никеля, образуя пятиокись никеля. Реакция может протекать как в восстановительных, так и в окислительных условиях в зависимости от начального соотношения компонентов.
Вопрос-ответ

Какое взаимодействие возникает между простыми веществами металлов и оксидами?
Взаимодействие между простыми веществами металлов и оксидами является химической реакцией, в результате которой образуются соли металлов и вода или кислород. Такие реакции могут протекать с выделением тепла или поглощением его.
Какие особенности имеет взаимодействие простых веществ металлов с оксидами?
Одной из особенностей является то, что взаимодействие простых веществ металлов с оксидами может протекать только при наличии достаточной активности металла. Некоторые металлы, такие как калий или натрий, очень активны и могут реагировать с окислами сильно выраженно.
Какие примеры можно привести взаимодействий простых веществ металлов с оксидами?
Примерами взаимодействий металлов с оксидами могут служить реакции алюминия с оксидом железа (Fe2O3), при которых образуется железо и газообразный кислород. Еще одним примером является реакция меди с оксидом серы (CuO), в результате которой образуется оксид меди (Cu2O) и выделяется кислород.
Может ли взаимодействие простых веществ металлов с оксидами протекать без образования солей?
Да, некоторые реакции взаимодействия металлов с оксидами могут протекать без образования солей. Например, при реакции алюминия с оксидом железа (Fe2O3), в результате образуется металлическое железо и газообразный кислород.
Какова значимость взаимодействия простых веществ металлов с оксидами в промышленности?
Взаимодействие простых веществ металлов с оксидами имеет большую значимость в промышленности. Например, реакция алюминия с оксидом железа (Fe2O3) используется для получения металлического железа в процессе производства стали. Также взаимодействие металлов с оксидами может применяться для получения различных металлических соединений или для получения кислорода.
