Кислоты являются химическими соединениями, которые обладают высокой степенью активности и способны взаимодействовать с различными веществами. Одним из таких веществ являются металлы. Взаимодействие паров кислоты с металлами не только приводит к химическим реакциям, но и имеет свои особенности и последствия.
Одной из особенностей взаимодействия паров кислоты с металлами является их энергичность. Кислоты обладают высокой концентрацией активных ионов в растворе, что позволяет им быстро проникать в структуру металла и вызывать его разрушение. При этом образуются оксиды и соли металлов, которые могут оказывать различное воздействие на окружающую среду.
Взаимодействие паров кислоты с металлами имеет также определенные последствия. Во-первых, это может привести к коррозии металла, то есть его постепенному разрушению вследствие химической реакции с кислотой. Коррозия может происходить как на поверхности металла, так и в его глубине, что значительно снижает его прочность и надежность. Во-вторых, взаимодействие паров кислоты с металлами может вызывать выбросы опасных веществ, которые могут негативно влиять на человека и окружающую среду.
Роль кислоты во взаимодействии с металлами
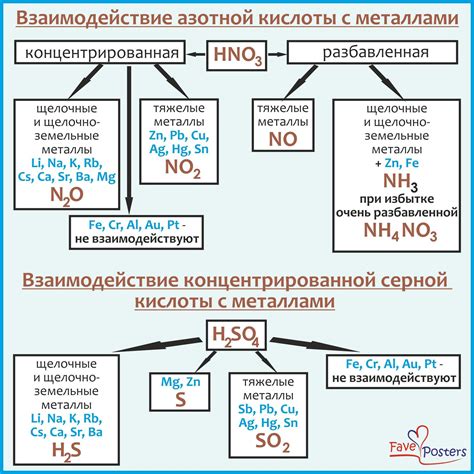
Кислоты играют важную роль во взаимодействии с металлами, образуя с ними различные соединения и способствуя их разрушению или защите. Взаимодействие паров кислоты с металлами может привести к образованию оксидов, солей или газовых соединений.
Пары кислоты, вступая в контакт с поверхностью металла, могут вызвать коррозию, то есть разрушение металлической структуры под воздействием окислительно-восстановительных реакций. Некоторые металлы, такие как железо, алюминий или цинк, при образовании оксидных пленок на поверхности приобретают повышенную стойкость к дальнейшему осаждению оксидов и солей. В случае же повреждения пленки, кислота может проникнуть вглубь металла и вызвать его разрушение.
Также кислоты могут быть использованы для удаления оксидных слоев с поверхности металла и очистки его от загрязнений. Этот процесс называется пассивацией, и он применяется, например, в металлургии для обработки пленок на поверхности перед последующей обработкой или покрытием.
Взаимодействие паров кислоты с металлами часто сопровождается выделением газовых соединений. Например, при реакции соляной кислоты с металлом цинка образуется гидроксид цинка и выделяется водород. Это можно использовать, например, для осуществления химического анализа или преобразования металлов в полезные соединения.
Такие реакции между кислотами и металлами имеют важное практическое значение и используются в различных отраслях промышленности и науке. Они позволяют не только получать новые соединения, но и изучать физико-химические свойства металлов и кислот, а также разрабатывать новые методы защиты от коррозии и очистки поверхностей от загрязнений.
Процесс взаимодействия
Процесс взаимодействия паров кислоты с металлами является сложным химическим процессом, в результате которого могут возникать различные последствия. Кислота способна реагировать с поверхностью металла, приводя к образованию оксидных пленок, солей или других химических соединений.
Взаимодействие кислоты с металлом зависит от их химических свойств и активности. Сильные кислоты, такие как серная или хлорная кислоты, обладают высокой реакционной способностью и могут вызывать интенсивное коррозионное повреждение металлической поверхности.
Взаимодействие паров кислоты с металлом может приводить к различным последствиям, включая коррозию металла, образование газов, тепловые реакции и изменение структуры материала. Коррозия металла может привести к его разрушению или потере механической прочности.
В случае образования газов, например, водорода, возможно образование пузырьков или пена на поверхности металла. Данные явления могут вызвать механические повреждения и изменение физических свойств материала.
Изменение структуры материала может привести к нарушению его свойств и потере функциональности. Для предотвращения или снижения отрицательных последствий взаимодействия кислоты с металлом используются различные методы защиты, такие как покрытие металла пленкой, применение защитных покрытий или использование специальных сплавов.
Кислотность и основность взаимодействия паров кислоты с металлами
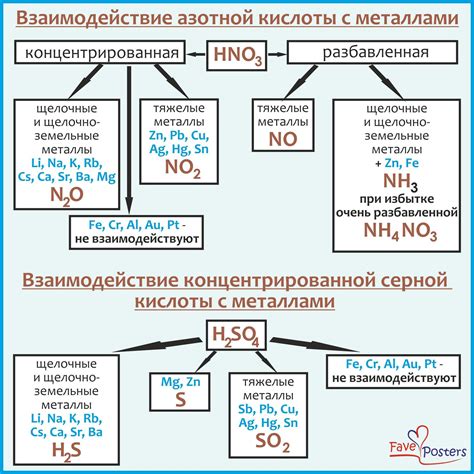
Взаимодействие паров кислоты с металлами является важной частью изучения химических процессов. Кислотность и основность реакции определяются свойствами собственно кислоты и металла.
Кислотность проявляется в способности кислоты отдавать протоны при реакции с металлом. Это происходит из-за высокой электроотрицательности кислоты, которая позволяет ей притягивать электроны, необходимые для образования новых химических связей с металлом. При этом, образуются соединения ионного типа между кислотой и металлом.
Основность проявляется в способности металла отдавать электроны при реакции с кислотой. Металлы, будучи металлическими элементами, обладают низкой электроотрицательностью, что позволяет им легко передавать свои электроны кислоте.
Реакция кислоты с металлом может протекать с образованием водорода, а также с образованием солей металла. Водород может выделяться в виде газа, а соли металлов могут образовывать химически стабильные соединения.
Таким образом, взаимодействие паров кислоты с металлами зависит как от кислотности, так и от основности реагирующих веществ. При этом, электроотрицательность кислоты и металла играет важную роль в процессе химической реакции.
Роль концентрации кислоты

Концентрация кислоты играет важную роль во взаимодействии с металлами. Повышение концентрации кислоты увеличивает скорость химической реакции с металлом. Чем выше концентрация кислоты, тем быстрее происходит коррозия металла.
Взаимодействие паров кислоты с металлами также зависит от концентрации кислоты. При низкой концентрации кислоты в паровой фазе, химическая реакция с металлом может быть медленной или вообще не возникнуть. Однако, при высокой концентрации кислоты в паровой фазе, возможно быстрое и интенсивное взаимодействие с металлом.
Концентрация кислоты также влияет на последствия взаимодействия с металлами. При более высоких концентрациях кислоты могут возникать более сильные коррозионные процессы, что может приводить к разрушению и повреждению металлических конструкций.
Концентрация кислоты должна учитываться при планировании химических процессов и выборе материалов для конструкций. Необходимо точно определить не только вид кислоты, но и ее концентрацию, чтобы избежать нежелательных последствий взаимодействия с металлами.
Влияние природы кислоты

Природа кислоты оказывает значительное влияние на процесс взаимодействия с металлами, так как различные химические соединения имеют разную активность и реакционную способность. Одним из ключевых факторов, определяющих природу кислоты, является их концентрация. Чем выше концентрация кислоты, тем более активной она является и тем больше она способна реагировать с металлами.
Также важным фактором является оксидационное состояние кислоты. Оксидационное состояние показывает, сколько электронов передал кислород в молекуле кислоты. Кислоты с более высоким оксидационным состоянием обладают большей реакционной способностью по сравнению с кислотами с низким оксидационным состоянием.
Кроме этого, влияние на взаимодействие кислоты с металлами оказывает их структура. Например, некоторые кислоты имеют способность образовывать комплексные соединения с металлами, что влияет на их реакционную способность. Другие кислоты могут образовывать стабильные оксиды металлов, что также влияет на характер реакции.
Таким образом, природа кислоты – это основной фактор, определяющий характер и последствия взаимодействия с металлами. Концентрация кислоты, ее оксидационное состояние и структура играют важную роль в этом процессе. Необходимо учитывать все эти факторы при анализе и предсказании последствий взаимодействия паров кислоты с металлами.
Образование солей при взаимодействии

Соли образуются в результате взаимодействия паров кислоты с металлами. Это процесс, при котором ионы металла и ионы кислоты соединяются, образуя новое вещество – соль.
Взаимодействие металлов с кислотами основано на реакции окисления-восстановления, при которой происходит перенос электронов. При этом ионы металла окисляются, а ионы кислоты восстанавливаются. Такие реакции могут быть сопровождены выделением газа и тепла.
Полученные соли могут иметь разные свойства. Одни соли образуют кристаллические структуры, другие – аморфные. Некоторые соли растворяются в воде, образуя электролитические растворы, а другие плохо растворимы или вообще нерастворимы.
Образование солей при взаимодействии паров кислоты с металлами играет важную роль в различных процессах. Например, такие реакции используются в промышленности для получения различных химических соединений и материалов. Кроме того, соли широко применяются в жизни человека – в кулинарии, медицине, сельском хозяйстве и других областях.
Коррозия металлов под воздействием кислот

Коррозия металлов является одной из наиболее распространенных проблем, с которыми сталкиваются многие индустриальные и неиндустриальные процессы. Кислоты могут вызывать коррозию металлов, влияя на их структуру и свойства. Коррозия металлов под воздействием кислот ведет к появлению окиси, которая может привести к разрушению металла и значительному снижению его прочности и долговечности.
Главной причиной коррозии металлов под воздействием кислот является химическая реакция, происходящая между металлом и кислотой. В результате реакции образуется вода и соли, что приводит к образованию пузырьков газа и коррозионной риски на поверхности металла. Чем сильнее кислота, тем быстрее протекает процесс коррозии.
Особенностью коррозии металлов под воздействием кислот является то, что она может происходить уже при небольших концентрациях кислоты. Даже слабые кислоты, такие как уксусная или лимонная, могут вызывать коррозию некоторых металлов, таких как цинк или алюминий. Однако наиболее сильные кислоты, такие как серная или хлороводородная, способны быстро разрушить даже самые стойкие металлы.
Для защиты металлов от коррозии под воздействием кислот могут применяться различные методы. Одним из них является нанесение защитных покрытий на поверхность металла, которые предотвращают контакт с кислотой. Также могут использоваться антикоррозионные покрытия и специальные лаки, повышающие устойчивость металла к коррозии. Важно также правильно выбрать материал для конкретных условий эксплуатации, учитывая факторы, такие как тип кислоты, ее концентрация и температура окружающей среды.
Влияние температуры на взаимодействие
Температура является важным фактором, влияющим на взаимодействие паров кислоты с металлами. Увеличение температуры обычно способствует активации химических реакций и ускоряет процесс разрушения металла.
При повышении температуры кислотная реакция становится более интенсивной, так как частицы металла получают больше энергии и могут легче преодолевать энергетический барьер, необходимый для инициирования реакции. Это может привести к более быстрому разрушению металла и образованию большего количества продуктов реакции.
Также следует отметить, что при высокой температуре металлы могут проявлять сильную реакцию с кислотой, особенно если они находятся в порошкообразной или мелкой форме. В результате такой реакции металл может разложиться с выделением горящих газов или даже произойти взрыв.
Однако стоит заметить, что не все металлы одинаково реагируют на воздействие кислоты при повышенной температуре. Некоторые металлы, такие как золото или платина, обладают высокой устойчивостью к кислотам, даже при высоких температурах. Такие металлы могут быть использованы в процессах, требующих высокой температуры и взаимодействия с кислотой.
Методы защиты от воздействия кислот

Защита от воздействия кислот является важным аспектом в области безопасности и обработки пищевых продуктов. Существует несколько методов, которые позволяют защитить металлы от коррозии и разрушения под воздействием кислотных паров.
Один из методов защиты – это применение защитных покрытий. Тонкий слой некоррозионного материала, такого как полимеры или оксиды металлов, наносится на поверхность металла. Это позволяет предотвратить воздействие кислотных паров на металл и сохранить его интегритет.
Еще одним методом защиты является использование кислотоустойчивых сплавов. Это специальные металлические соединения, которые обладают высокой устойчивостью к коррозии под воздействием кислотных сред. Данные сплавы часто используются в промышленности, где контакт с кислотами неизбежен.
Также можно применять физические методы защиты от воздействия кислот. Например, использование анодной защиты, при которой на поверхность металла наносится ток, который образует защитную пленку. Эта пленка предотвращает контакт металла с кислотами и предотвращает его повреждение.
Использование силиконовых вкладышей или прокладок также является распространенным методом защиты от воздействия кислот. Силикон обладает химической инертностью по отношению к кислотам и позволяет предотвратить их воздействие на металл.
Важно выбрать подходящий метод защиты в зависимости от конкретной ситуации и условий эксплуатации. Необходимо учитывать тип кислоты, степень ее агрессивности, а также особенности материала, который нужно защитить.
Вопрос-ответ

Как происходит взаимодействие паров кислоты с металлами?
Взаимодействие паров кислоты с металлами происходит путем образования солей и выделения водорода. Кислота реагирует с поверхностью металла, образуя соединение (соль), а образовавшийся водород может образовать газообразные пузырьки.
Какие металлы реагируют с паром кислоты?
Реагировать с паром кислоты могут различные металлы, но степень и скорость реакции могут различаться. Некоторые из самых активных металлов, которые реагируют с паром кислоты, включают натрий, калий и цезий. Однако многие другие металлы могут также реагировать с кислотами, в зависимости от их активности и химической структуры.
Какие последствия может иметь взаимодействие паров кислоты с металлами?
Взаимодействие паров кислоты с металлами может иметь различные последствия в зависимости от условий реакции. В некоторых случаях может происходить коррозия металла, то есть разрушение его структуры и образование окислов и солей. Кроме того, выделение водорода при реакции кислоты с металлом может привести к возникновению взрывоопасной смеси воздуха и водорода. Поэтому взаимодействие паров кислоты с металлами требует особой осторожности и контроля условий реакции.
