Оксиды щелочных металлов - это соединения металлов с кислородом, которые обладают основными свойствами. Когда эти оксиды взаимодействуют с водой, происходит образование щелочей - растворов, обладающих высоким pH и способных нейтрализовать кислоты.
Вода, вступая в реакцию с оксидами щелочных металлов, образует гидроксиды. Например, взаимодействие оксида натрия (Na2O) с водой дает гидроксид натрия (NaOH). Эта реакция является экзотермической и сопровождается выделением большого количества тепла.
Помимо взаимодействия с водой, оксиды щелочных металлов также могут реагировать с кислотными оксидами. В результате таких реакций образуются соли. Например, оксид калия (K2O) может реагировать с диоксидом серы (SO2) и образовывать сульфат калия (K2SO4).
Взаимодействие оксидов щелочных металлов с водой и кислотными оксидами является важным процессом в химии и имеет широкое применение в различных областях науки и промышленности. Понимание этих реакций позволяет контролировать pH среды, получать необходимые соединения и проводить различные химические синтезы.
Оксиды щелочных металлов: общая характеристика

Оксиды щелочных металлов являются химическими соединениями, состоящими из атомов щелочных металлов и кислорода. Они обладают высокой щелочностью и обычно имеют щелочную реакцию взаимодействия с водой.
Щелочные металлы, такие как литий, натрий, калий и др., находятся в первой группе периодической системы элементов. Они образуют стабильные оксиды, которые могут быть представлены в различных степенях окисления.
Взаимодействие оксидов щелочных металлов с водой является экзотермическим процессом, при котором возникает выделение тепла. При контакте с водой оксиды щелочных металлов превращаются в соответствующие гидроксиды. Например, оксид натрия (Na2O) реагирует с водой, образуя гидроксид натрия (NaOH):
Na2O + H2O → 2NaOH
Оксиды щелочных металлов также могут реагировать с кислотными оксидами, образуя соли. Например, смешивание оксида натрия и оксида серы приводит к образованию гидросульфата натрия:
Na2O + SO2 → Na2SO3
Таким образом, оксиды щелочных металлов играют важную роль в множестве химических реакций, связанных с водой и кислотными оксидами.
Реакция оксидов щелочных металлов с водой

Оксиды щелочных металлов - это соединения, широко распространенные в природе и имеющие важное значение в химии и технологии. Они реагируют с водой, образуя щелочи - химические соединения, которые обладают выраженными основными свойствами.
Реакция оксидов щелочных металлов с водой происходит с выделением большого количества тепла и образованием гидроксидов источник. Как правило, процесс сопровождается образованием пены или пузырьков, что свидетельствует о выделении газа.
Например, оксид натрия (Na2O) реагирует с водой с образованием гидроксида натрия (NaOH):
Na2O + H2O → 2NaOH
А оксид калия (K2O) при взаимодействии с водой даёт гидроксид калия (KOH):
K2O + H2O → 2KOH
Реакция рассчитана на массу вещества, поэтому соотношение между оксидами и водой должно соблюдаться по коэффициентам стехиометрии.
Взаимодействие оксидов щелочных металлов с кислотными оксидами

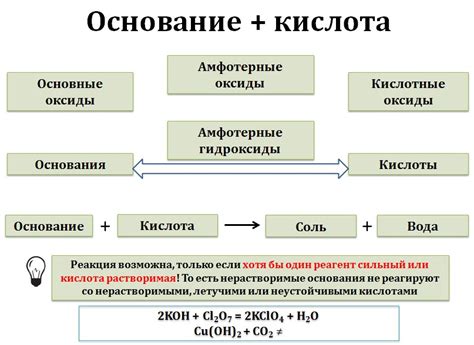
Взаимодействие оксидов щелочных металлов с кислотными оксидами является важной химической реакцией. При таком взаимодействии образуются соли и вода.
Оксиды щелочных металлов, такие как оксид натрия (Na2O) и оксид калия (K2O), обладают щелочными свойствами и могут нейтрализовать кислотные оксиды, например, оксид серы (SO3) и оксид азота (NO2).
В результате смешивания оксида щелочного металла с кислотным оксидом и последующего взаимодействия, образуется соль – соединение, в состав которого входят катионы щелочных металлов и анионы кислотных оксидов.
Примером реакции взаимодействия может служить реакция оксида натрия с оксидом серы:
Na2O + SO3 → Na2SO4
В данной реакции образуется соль – сульфат натрия (Na2SO4) и вода. Такие реакции играют важную роль в производстве различных соединений и материалов.
Взаимодействие оксидов щелочных металлов с кислотными оксидами является одной из основных реакций химии и имеет широкие применения в промышленности и научных исследованиях.
Оксид щелочного металла как основание
Оксид щелочного металла – это химическое соединение, которое обладает щелочными свойствами. Это означает, что оксиды щелочных металлов обладают способностью реагировать с водой и кислотными оксидами, проявляя свои основные свойства.
Оксиды щелочных металлов, такие как оксид натрия (Na2O), оксид калия (K2O) и оксид лития (Li2O), могут растворяться в воде, образуя щелочные растворы. При этом происходит гидратация оксида с образованием гидроксида щелочного металла и выделением тепла.
Оксиды щелочных металлов могут также реагировать с кислотными оксидами, образуя соли. Эта реакция называется кислотно-основным взаимодействием. Например, оксид натрия может реагировать с оксидом серы, образуя соль сульфата натрия (Na2SO4).
Оксиды щелочных металлов широко используются в различных отраслях промышленности, таких как производство стекла, металлургия, электроника и другие. Они являются важными компонентами в производстве щелочей и щелочных растворов. Кроме того, оксиды щелочных металлов часто используются в качестве катализаторов и в промышленном синтезе органических соединений.
Таким образом, оксиды щелочных металлов играют важную роль в химии и промышленности, проявляя свои основные свойства при взаимодействии с водой и кислотными оксидами.
Оксид щелочного металла как катализатор
Оксиды щелочных металлов имеют широкое применение в качестве катализаторов, обладая высокой активностью и стабильностью. Они играют важную роль в различных химических реакциях, в том числе взаимодействии с водой и кислотными оксидами.
Одним из ключевых преимуществ оксидов щелочных металлов в качестве катализаторов является их способность образовывать активные центры поверхности, которые способствуют ускорению химических реакций. Благодаря своей высокой поверхностной активности, оксиды щелочных металлов облегчают процесс физической и химической адсорбции реагентов.
Оксиды щелочных металлов также обладают высокой щелочностью, что делает их эффективными катализаторами реакций гидролиза воды. Благодаря этим свойствам, оксиды щелочных металлов находят широкое применение в процессе производства водорода, который играет важную роль как источник энергии и сырья для различных отраслей промышленности.
Кроме того, оксиды щелочных металлов могут использоваться в качестве катализаторов при реакциях с кислотными оксидами. Они способны образовывать с кислотными оксидами соли, что позволяет ускорять химические реакции и повышать их эффективность. Такие реакции часто используются в органическом синтезе и процессах получения различных веществ.
Использование оксидов щелочных металлов в промышленности

Оксиды щелочных металлов широко используются в промышленности благодаря своим уникальным свойствам. Например, гидроксид натрия (NaOH) или щелочь, получаемая при взаимодействии воды с оксидом натрия (Na2O), является одним из основных продуктов в химической промышленности.
Гидроксид натрия используется в процессах очистки воды, производстве стекла, металлургии, бумажном производстве и производстве мыла. Он является основным компонентом для регулирования pH растворов, применяется в производстве различных производственных смазок и изделий из резины.
Оксиды щелочных металлов также находят применение в производстве кислотных оксидов. Например, оксид калия (K2O) может использоваться в качестве катализатора в процессах синтеза органических соединений. Он также используется в качестве ингредиента в стекле, керамике и удобрениях.
Значительное применение оксидов щелочных металлов находит в производстве сырья для электролитических суперконденсаторов, аккумуляторов и гальванических элементов. Оксиды щелочных металлов обеспечивают высокую электропроводность и стабильность химических процессов, необходимых для эффективной работы этих устройств.
Таким образом, оксиды щелочных металлов играют важную роль в промышленности, обеспечивая необходимые свойства и функциональность в различных сферах производства.
Факторы, влияющие на реакцию оксидов щелочных металлов с водой и кислотными оксидами

Взаимодействие оксидов щелочных металлов с водой и кислотными оксидами может быть описано различными факторами, которые влияют на характер и скорость реакции.
Один из основных факторов - это химическая активность оксидов щелочных металлов. Чем выше активность металла, тем более быстрая и интенсивная будет реакция с водой или кислотными оксидами. Например, оксид натрия (Na2O) является очень активным и реагирует с водой с образованием щелочи. В то же время, оксид калия (K2O) менее активен и реакция с водой происходит медленнее.
Другим фактором, влияющим на реакцию, является концентрация реагентов. Чем выше концентрация оксида и воды, тем сильнее будет протекать реакция. Это связано с тем, что большее количество частиц реагентов увеличивает вероятность их столкновения и, следовательно, скорость реакции.
Также важным фактором является температура реакции. При повышении температуры происходит активация молекул и увеличение их скорости движения, что позволяет реакции протекать быстрее. Однако, при очень высоких температурах могут происходить и другие химические процессы, влияющие на характер реакции.
Кроме того, катализаторы могут значительно повлиять на реакцию оксидов щелочных металлов. Они способны ускорять химические процессы, участвуя в них, но остаются неизменными по химическому составу. Катализаторы могут снижать энергию активации реакции и увеличивать число столкновений между реагентами, что способствует более быстрой и эффективной реакции оксида с водой или кислотными оксидами.
Все эти факторы взаимодействуют друг с другом и определяют особенности химических реакций, связанных с оксидами щелочных металлов, при их контакте с водой и кислотными оксидами.
Перспективы исследований взаимодействия оксидов щелочных металлов с водой и кислотными оксидами

Разработка новых материалов с использованием оксидов щелочных металлов и их взаимодействие с водой и кислотными оксидами представляет собой актуальную и перспективную область научных исследований. Взаимодействие этих соединений имеет широкий спектр применений в различных отраслях науки и промышленности.
Одним из направлений исследований является изучение влияния оксидов щелочных металлов на процессы гидратации. Вода, вступая в реакцию с оксидами, приводит к образованию гидрооксидов щелочных металлов, которые могут использоваться в качестве катализаторов, сорбентов и других функциональных материалов. Исследования этого процесса позволят оптимизировать условия реакции и создать новые эффективные катализаторы.
Другим важным направлением исследований является изучение взаимодействия оксидов щелочных металлов с кислотными оксидами. В результате данной реакции образуются соли, которые имеют высокую растворимость и могут использоваться в различных технологических процессах.
Также, исследования взаимодействия оксидов щелочных металлов с водой и кислотными оксидами могут способствовать разработке новых материалов с уникальными свойствами. Например, оксиды щелочных металлов могут быть использованы для создания керамических материалов с высокой прочностью и стабильностью.
Таким образом, исследование взаимодействия оксидов щелочных металлов с водой и кислотными оксидами имеет большую практическую значимость и открывает широкие перспективы для создания новых материалов и технологий в различных отраслях науки и промышленности.
Вопрос-ответ

Какие реакции происходят при взаимодействии оксидов щелочных металлов с водой?
При взаимодействии оксидов щелочных металлов с водой происходит гидролиз, в результате которого образуется щелочной гидроксид и выделяется теплота.
Какая реакция происходит при взаимодействии оксидов щелочных металлов с кислотными оксидами?
При взаимодействии оксидов щелочных металлов с кислотными оксидами образуются соли и вода. Эта реакция называется нейтрализацией.
Какие свойства имеют оксиды щелочных металлов?
Оксиды щелочных металлов являются основными оксидами, то есть они растворяются в воде, образуя щелочные растворы. Они также обладают щелочной реакцией и могут выделять теплоту при взаимодействии с водой.
Какие особенности взаимодействия оксидов щелочных металлов с водой?
Взаимодействие оксидов щелочных металлов с водой происходит с выделением теплоты и образованием щелочных растворов. При этом можно наблюдать плавление оксида и его растворение в воде с образованием гидроксидов.
Какие оксиды щелочных металлов самые активны?
Среди оксидов щелочных металлов самыми активными являются оксиды натрия (Na2O) и калия (K2O). Они сильно реагируют с водой, образуя щелочные растворы, а также хорошо реагируют с кислотными оксидами, образуя соли и воду.
