Оксиды металлов - это неорганические соединения, состоящие из металла и кислорода. Изучение взаимодействия оксидов металлов с кислотами является важной задачей в химии. Не все металлические оксиды могут растворяться в кислотах, поэтому определение ионного состава оксидов металлов имеет особую важность.
Одним из способов определения ионного состава оксидов металлов является их взаимодействие с серной кислотой. При контакте оксида металла с серной кислотой происходит реакция, в результате которой образуются сульфат металла и вода.
Например, взаимодействие оксида меди (II) с серной кислотой представляется следующим уравнением реакции:
СuO + H₂SO₄ → CuSO₄ + H₂О
Таким образом, по реакционной схеме можно определить, находится ли реагент в оксидной форме, а также узнать его ионную форму в результате взаимодействия с серной кислотой. Это позволяет провести анализ металлических оксидов и определить их свойства и возможности для применения в различных областях промышленности и науки.
Отличие взаимодействия оксида металла с серной кислотой
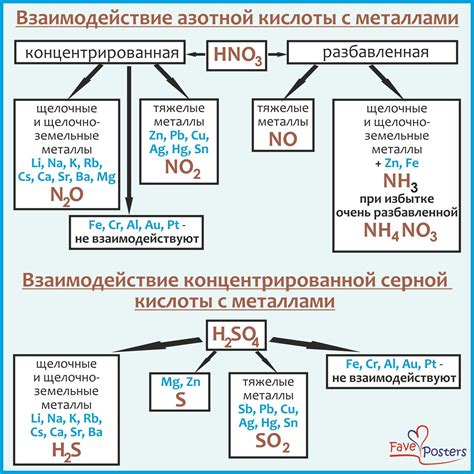
Взаимодействие оксида металла с серной кислотой может происходить по-разному в зависимости от типа оксида и его активности.
Один из способов взаимодействия заключается в растворении оксида металла в серной кислоте. При этом металл окисляется, а серная кислота восстанавливается. Образуется солевой основной анион и вода. Процесс растворения может протекать медленно, если оксид металла образует стабильную пленку оксида на поверхности.
Другим способом взаимодействия оксида металла с серной кислотой может быть образование кислых растворов. При этом оксид металла проявляет амфотерные свойства и реагирует как с лугом, так и с кислотой. Реакция проходит по типу гидролиза, при котором образуются ионы металла и гидроксидные ионы.
Стоит отметить, что взаимодействие оксида металла с серной кислотой может протекать с образованием не только воды, но и других продуктов реакции, таких как азотные оксиды или сульфаты. Это зависит от конкретного металлооксида и условий реакции.
Реакция оксида металла с серной кислотой: бурная и селективная
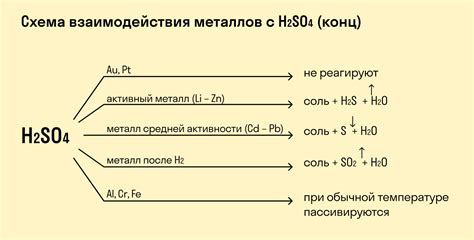
Взаимодействие оксида металла с серной кислотой является процессом, при котором происходит реакция оксида металла с серной кислотой. Оксид металла, в свою очередь, является химическим соединением, содержащим металл и кислород. Серная кислота, в свою очередь, представляет собой соединение серы и кислорода.
Реакция между оксидом металла и серной кислотой проходит с бурной реакцией, что означает высокую реакционную активность данных веществ. В результате реакции образуются продукты, такие как соль и вода. Процесс взаимодействия оксида металла с серной кислотой является экзотермическим, то есть сопровождается выделением теплоты.
Одной из особенностей реакции оксида металла с серной кислотой является ее селективность, то есть возможность осуществления реакции только с определенными оксидами металлов. Это объясняется различной активностью металлов и их оксидов. Некоторые металлы могут реагировать с серной кислотой, образуя соответствующие соли, в то время как другие металлы могут быть инертными при взаимодействии с данным кислотным соединением.
Реакция оксида металла с серной кислотой имеет широкое применение в различных отраслях промышленности и научных исследованиях. Она используется для получения определенных солей металлов, а также в качестве метода анализа содержания оксидов металлов в различных веществах. Бурная реакция и селективность данного процесса делают его важным объектом изучения в химии.
Аналитическое применение оксида металла в определении металлов

Оксид металла является важным инструментом в аналитической химии для определения наличия и концентрации различных металлов. Этот метод основан на химической реакции между оксидом металла и раствором соответствующей кислоты. В результате этой реакции образуется солевой осадок, который может быть использован для определения металла.
Определение металлов с использованием оксида металла основано на принципе растворимости солей металлов в кислотной среде. При взаимодействии оксида металла с серной кислотой происходит образование сульфата металла. Таким образом, присутствие металла можно обнаружить по образованию осадка сульфата этого металла.
Для определения металла с использованием оксида металла можно использовать качественные и количественные методы анализа. В качественном анализе можно использовать наблюдение за образованием осадка и его характеристиками, такими как цвет, плотность и форма. Количественный анализ позволяет определить концентрацию металла в растворе с помощью специальных методов и инструментов.
Аналитическое применение оксида металла в определении металлов является важным шагом для контроля качества и исследования состава различных образцов. Этот метод позволяет быстро и точно определить наличие и концентрацию металлов, что имеет большое значение во многих областях, включая промышленность, медицину и экологию.
Квантово-химическое исследование взаимодействия оксида металла с серной кислотой
Оксид металла, как известно, является неорганическим соединением, состоящим из металла и кислорода. Взаимодействие данного вещества с серной кислотой представляет собой сложный процесс, важность которого заключается в понимании механизма химической реакции.
Квантово-химическое исследование позволяет установить особенности взаимодействия оксида металла с серной кислотой на молекулярном уровне. С помощью методов квантовой механики и компьютерного моделирования, ученые могут предсказать структуру и свойства новых соединений, а также раскрыть механизмы реакций.
В ходе исследования было установлено, что при взаимодействии оксида металла с серной кислотой происходит образование соединений, содержащих металлические и серные ионы. Также было выявлено, что тип оксида металла и его структурные особенности влияют на скорость и степень реакции.
Квантово-химическое исследование взаимодействия оксида металла с серной кислотой не только позволяет лучше понять процессы, происходящие на молекулярном уровне, но и может быть полезным при разработке новых катализаторов, электронных компонентов и других материалов с определенными свойствами.
Кислотная и щелочная стойкость оксида металла и комплексообразование

Кислотная и щелочная стойкость оксида металла является одним из важных свойств этого соединения. Оксид металла способен образовывать сильные комплексные соединения с различными кислотами, такими как серная кислота. Комплексообразование происходит в результате реакции оксида металла с кислотой, при которой образуется комплексный ион.
Комплексообразование оксида металла с серной кислотой происходит по следующему механизму. Сначала происходит совместная диссоциация молекул кислоты и оксида металла, при которой образуются ионы гидрона и ионы металла. Затем ионы гидрона реагируют с ионами металла, образуя комплексный ион. Комплексный ион имеет более высокую степень стабильности по сравнению с ионами гидрона и металла, поэтому реакция происходит в направлении образования комплексного соединения.
Кислотная и щелочная стойкость оксида металла связана с его способностью образовывать комплексные соединения. Если оксид металла обладает высокой кислотной стойкостью, то это означает, что он может образовывать комплексы как сильных, так и слабых кислот. Если оксид металла имеет высокую щелочную стойкость, то он способен образовывать комплексы с щелочами. Взаимодействие оксида металла с серной кислотой свидетельствует о его кислотной стойкости и способности образовывать стойкие комплексы.
Комплексообразование оксида металла с серной кислотой имеет широкое применение в различных областях, таких как химическая промышленность, металлургия, фармацевтика и др. Комплексы оксида металла с серной кислотой могут использоваться как катализаторы, а также в процессах сорбции и экстракции различных веществ.
Оксид металла в фотонике и электронике: возможности и перспективы

Оксиды металлов стали неотъемлемой частью различных устройств в фотонике и электронике благодаря своим уникальным физическим и химическим свойствам.
Одной из основных возможностей оксида металла в фотонике является его способность функционировать в качестве полупроводника. Благодаря этому свойству, оксиды металлов применяются в различных электронных устройствах, таких как транзисторы, датчики, солнечные панели и другое. Они обладают высокой электропроводностью и отличными оптическими свойствами, что делает их идеальными для использования в фотонике.
Перспективы применения оксида металла в фотонике и электронике также связаны с его способностью образовывать стабильные и прочные пленки. Это позволяет создавать тонкие слои оксида металла на различных подложках, включая стекло, кремний и другие материалы. Это открывает возможности для создания новых материалов и устройств с улучшенными характеристиками и функциональностью.
Важно отметить, что оксиды металлов также обладают фотолюминесцентными свойствами, что делает их полезными для разработки светодиодов и лазеров. Эти свойства позволяют использовать оксид металла для создания эффективных источников света с широким спектром применения, включая дисплеи, освещение, оптическую связь и другое.
Использование оксида металла в фотонике и электронике имеет большой потенциал и предоставляет возможности для разработки новых устройств с улучшенными характеристиками, надежностью и энергоэффективностью. Благодаря своим уникальным свойствам, оксиды металлов продолжают оставаться в центре внимания исследователей и инженеров, которые стремятся создать инновационные решения для современной технологии.
Сравнение оксида металла с другими оксидами при взаимодействии с серной кислотой

Взаимодействие оксида металла с серной кислотой является важным химическим процессом, который может приводить к образованию солей и выделению газов. Оксиды металлов могут иметь разные свойства и реактивность при контакте с серной кислотой, поэтому важно сравнить их поведение.
Существует несколько типов оксидов металлов, которые можно сравнивать с точки зрения их реактивности с серной кислотой. Один из типов оксидов - основные, которые способны образовывать соли при взаимодействии с кислотами. Например, оксид кальция (CaO) образует сульфат кальция (CaSO4) при реакции с серной кислотой.
Другой тип оксидов - амфотерные, которые могут проявлять как свойства кислоты, так и свойства щелочи при взаимодействии с разными реактивами. Амфотерные оксиды способны образовывать как соли, так и гидроксиды при контакте с серной кислотой. Например, оксид алюминия (Al2O3) может образовывать соль алюминия (Al2(SO4)3) и гидроксид алюминия (Al(OH)3).
Третий тип оксидов - кислотные оксиды. Они образуют кислоты при растворении в воде и могут образовывать соли при взаимодействии с щелочами. Однако, кислотные оксиды не образуют соли при взаимодействии с серной кислотой. Например, оксид углерода (CO2) не дает соли при контакте с серной кислотой.
Таким образом, взаимодействие оксида металла с серной кислотой зависит от типа оксида и его реактивности. Основные и амфотерные оксиды способны образовывать соли при взаимодействии с серной кислотой, в то время как кислотные оксиды этого не делают. Это позволяет предсказывать результаты реакций оксидов металлов с серной кислотой в зависимости от их типа и состава.
Оксид металла в промышленной химии: преимущества и области применения

Оксиды металлов представляют собой важную группу химических соединений, широко применяемых в промышленности. Они обладают рядом преимуществ, которые делают их незаменимыми во многих областях деятельности.
Преимущество оксидов металлов заключается в их высокой химической стабильности. Это значит, что они могут выдерживать высокие температуры, агрессивные вещества и атмосферные условия без значительного разрушения или изменения своих свойств. Благодаря этому оксиды металлов широко используются в производстве катализаторов, керамики, стекла и других материалов, требующих высокой стойкости.
Оксиды металлов также обладают специфическими физическими свойствами, которые делают их ценными материалами в различных областях. Например, некоторые оксиды металлов имеют полупроводниковые свойства и применяются в электронике для создания полупроводниковых приборов, таких как диоды и транзисторы.
В промышленности оксиды металлов находят применение во многих отраслях. Они используются как катализаторы в химических процессах, ускоряющие реакции и повышающие эффективность производства. Оксиды металлов добавляются в краски и пигменты для придания им особых свойств, таких как стойкость к ультрафиолету и высокую яркость цвета. Также оксиды металлов применяются в качестве наноматериалов для создания новых материалов с уникальными свойствами.
В целом, оксиды металлов играют важную роль в промышленности и находят применение во множестве областей. Их высокая стабильность, специфические физические свойства и возможность использования как катализаторы делают их полезными и востребованными материалами. Благодаря постоянному развитию и исследованиям в области химии и материаловедения, оксиды металлов продолжат находить новые области применения и расширять границы своей эффективности.
Вопрос-ответ

Каким образом взаимодействует оксид металла с серной кислотой?
Оксид металла взаимодействует с серной кислотой, образуя соль и воду. Процесс происходит следующим образом: оксид металла реагирует с серной кислотой, образуя соль металла и воду. Например, если речь идет об оксиде железа, то при взаимодействии с серной кислотой образуется соль железа и вода.
Как можно определить металл, который был использован для получения оксида металла?
Определить металл, который был использован для получения оксида металла, можно с помощью реакции взаимодействия оксида металла с серной кислотой. Каждый металл образует свою соль при взаимодействии с серной кислотой. Если известна формула получаемой соли, то можно однозначно определить, какой металл использовался для получения оксида.
