Оксиды щелочных металлов – это соединения, которые образуются при взаимодействии металлического щелочного элемента с кислородом. В процессе реакции происходит образование стабильного оксида, который часто обладает щелочными свойствами и может использоваться в различных сферах жизни.
Оксиды щелочных металлов широко применяются в промышленности, медицине, химической и фармацевтической отраслях. Они используются в процессе производства стекла, щелочных батарей, моющих средств и других продуктов. Благодаря своим особым свойствам, оксиды щелочных металлов играют важную роль в химическом производстве и обладают большими перспективами в развитии новых материалов и технологий.
Взаимодействие металла с кислородом приводит к образованию оксида щелочи металла. Этот процесс сопровождается выделением тепла и сопротивлением электрического тока, что может быть использовано в промышленности для получения энергии. Кроме того, образование оксида щелочи металла при взаимодействии с оксидом является важным физико-химическим явлением, которое влияет на многие процессы в природе и технологиях.
Оксид щелочи металла: формирование и свойства
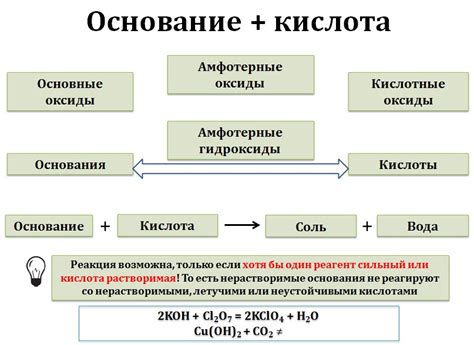
Образование оксида щелочи металла
Оксиды щелочных металлов образуются в результате взаимодействия металлических оксидов с щелочами. Например, при взаимодействии оксида натрия (Na2O) с щелочью, такой как гидроксид натрия (NaOH), образуется оксид натрия (Na2O). Под воздействием света и тепла, оксид натрия превращается обратно в гидроксид натрия.
Свойства оксида щелочи металла
Оксиды щелочных металлов обладают рядом уникальных свойств. Во-первых, они обладают высокой щелочностью и способностью реагировать с кислотами, образуя соли. Кроме того, оксиды щелочных металлов обладают способностью гидратироваться, то есть притягивать и удерживать молекулы воды. Это свойство позволяет им использоваться в процессе сушки газов.
Во-вторых, оксиды щелочных металлов обладают сравнительно высокими температурами плавления и кипения. Например, оксид натрия имеет температуру плавления около 1132°C. Это свойство позволяет использовать оксиды щелочных металлов в процессе получения высокотемпературных материалов.
Применение оксида щелочи металла
Оксиды щелочных металлов имеют широкое применение в различных областях. Например, оксид натрия используется в производстве стекла, щелочных плавиков и мыла. Оксид калия применяется в химической промышленности для получения различных солей, а оксид лития используется в производстве литий-ионных аккумуляторов.
Таким образом, оксиды щелочных металлов играют важную роль в различных индустриальных процессах. Их уникальные свойства делают их незаменимыми компонентами в производстве множества материалов и изделий.
Образование оксида щелочи металла при взаимодействии
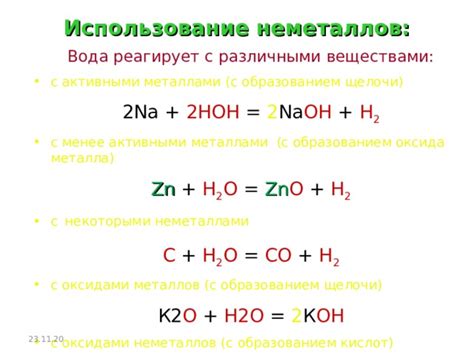
Взаимодействие оксидов металлов с щелочами может привести к образованию оксида щелочи металла. Этот процесс является одним из способов получения щелочных оксидов, которые широко применяются в различных отраслях промышленности.
В химической реакции между оксидом металла и щелочью происходит образование основного оксида. Оксид металла действует как кислота, а щелочь - как основание. При взаимодействии этих двух веществ образуется соль и вода.
Процесс образования оксида щелочи металла может быть представлен следующим уравнением реакции:
МО + 2NaOH → Na2О + M
где МО - оксид металла, NaOH - гидроксид натрия, Na2О - щелочь, M - элемент металла.
Полученный щелочной оксид может использоваться в различных отраслях промышленности. Например, оксид калия широко применяется в производстве стекла, щелочей, удобрений, а также в производстве препаратов для медицинской и фармацевтической отрасли.
Образование оксида щелочи металла при взаимодействии оксида металла с щелочью является важным химическим процессом, который играет значительную роль в различных отраслях промышленности и науке.
Свойства оксида щелочи металла
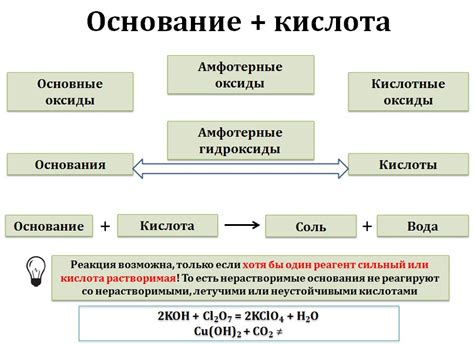
Оксид щелочи металла является основным оксидом и обладает рядом характерных свойств. Он образуется в результате взаимодействия щелочного металла с кислородом.
Оксид щелочи металла обладает кристаллической структурой и имеет высокую температуру плавления. Это означает, что он способен существовать в твердом состоянии при высоких температурах.
Оксид щелочи металла обладает щелочными свойствами, что проявляется в его способности образовывать соли с кислотами. Он также обладает гигроскопичностью, то есть способностью притягивать и задерживать влагу из окружающей среды.
Оксид щелочи металла является прекурсором для получения щелочной гидроксидной основы, при добавлении воды он образует гидроксид металла и выделяет большое количество тепла. Поэтому необходимо аккуратно обрабатывать оксид щелочи металла и избегать его контакта с влагой и кислотой.
Важным свойством оксида щелочи металла является его растворимость в воде. Он образует щелочные растворы, добавление которых может изменить химические и физические свойства раствора. Например, взаимодействие оксида натрия с водой приводит к образованию растворов, способных изменять кислотно-щелочной баланс и показатели pH.
Вопрос-ответ

Как образуется оксид щелочи металла при взаимодействии с оксидом?
Оксид щелочи металла образуется при взаимодействии оксида соответствующего металла с щелочью или щелочным оксидом. Реакция происходит путем передачи оксигена от оксида к щелочи, при этом образуется оксид щелочи металла.
Какие металлы образуют оксиды щелочи при взаимодействии с оксидом?
Оксиды щелочи образуются при взаимодействии оксидов металлов первой группы и некоторых металлов второй группы с щелочью или щелочными оксидами. Так, например, литий, натрий и калий образуют соответственно оксиды Li2O, Na2O и K2O при взаимодействии с оксидом кальция.
