Реакция водорода с металлами является одной из наиболее распространенных химических реакций. Водород входит в состав большинства металлов и может быть извлечен из них при определенных условиях. Это взаимодействие основано на способности металлов отдавать электроны и реагировать с водородом, образуя соединение между металлом и водородом.
Металлы реагируют с водородом при нагревании или контакте с кислородом. Водород может быть извлечен из металлов различными способами, включая термическую декомпозицию, электролиз и реакции с кислородом. В результате этих реакций образуются гидриды металлов, которые содержат водород в своей структуре.
Реакция водорода с металлами может иметь различные последствия. Некоторые металлы реагируют с водородом взрывоопасно, особенно при высокой температуре или давлении. В таких случаях необходимо соблюдать особые меры безопасности. Однако большинство реакций водорода с металлами происходят в мягкой форме, не образуя взрывчатых смесей. Эти реакции важны для получения чистого водорода, который может быть использован в различных областях, таких как производство энергии, химическая промышленность и металлургия.
Таким образом, реакция водорода с металлами является важным процессом, который позволяет извлекать водород из металлов и использовать его в различных сферах. Эта реакция имеет различные последствия и требует соблюдения мер безопасности, особенно при работе с металлами, которые могут реагировать с водородом взрывоопасно. Однако, правильно управляемая реакция водорода с металлами может привести к получению чистого водорода, который имеет широкое применение в нашей жизни.
Причины образования водорода
Реакция водорода с металлами является одним из самых важных процессов в химии. При контакте водорода с металлическими элементами образуется множество химических соединений, включая гидриды металлов. Образование водорода в результате взаимодействия металлов объясняется несколькими причинами.
Во-первых, активность металла играет решающую роль в образовании водорода. Большая часть металлов, расположенных в периодической системе элементов слева от водорода, имеет сильную аффинность к водороду и способна с ним реагировать. Это связано с электроотрицательностью металла, которая определяет его способность принимать электроны от водорода и образовывать ион водорода, а затем молекулы водорода. Таким образом, активные металлы, такие как натрий, калий и литий, образуют водородные соединения наиболее интенсивно.
Во-вторых, термодинамические условия, такие как температура и давление, также оказывают влияние на образование водорода. Некоторые металлы образуют водород только при высоких температурах, например, алюминий или железо. Для некоторых же металлов, таких как магний или цинк, образование водорода возможно при комнатной температуре. При повышении давления водорода увеличивается скорость образования гидридов металлов, так как давление является драйвером реакции.
И наконец, электрохимические свойства металлов влияют на их способность образовывать водород. Металлы, обладающие большой отрицательной электродной способностью, имеют высокую активность и способны образовывать водород. Например, цинк является хорошим редуктором и образует водород, а медь обладает низкой активностью и реакция с водородом происходит с трудом.
Экзотермические реакции растворения

Экзотермические реакции растворения – это процессы, при которых происходит выделение тепла во время химической реакции между металлами и водородом. В результате таких реакций металлы растворяются в водороде, образуя газообразные соединения.
При экзотермических реакциях растворения металлы обладают высокой химической активностью, что позволяет им легко взаимодействовать с водородом. В результате реакции образуется газообразный водородный соединения, такие как гидроксиды, гидриды и гидраты, которые легко растворяются в воде.
Примером экзотермической реакции растворения является реакция металла натрия с водородом. При этой реакции натрий образует гидроксид натрия (NaOH) и высвобождается водородный газ (H2), сопровождающийся выделением тепла.
Экзотермические реакции растворения металлов с водородом являются важным процессом в химической промышленности. Они используются для производства различных веществ, таких как гидроксиды, гидриды и гидраты, которые широко применяются в различных отраслях промышленности и научных исследованиях.
Реакции с кислотами
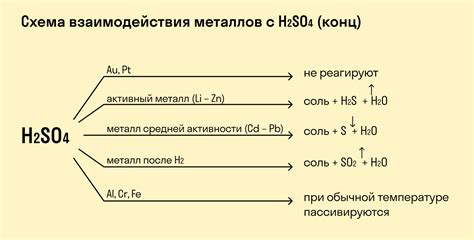
1. Реакция водорода с солями:
В реакциях водорода с солями обычно образуется соль и выделяется водород. Например, при взаимодействии цинка с соляной кислотой образуется хлорид цинка и выделяется водород:
2HCl + Zn → ZnCl2 + H2
Такие реакции широко применяются в химической промышленности, например, для получения хлорида железа или алюминия.
2. Реакция водорода с оксидами:
В реакциях водорода с металлическими оксидами образуется соответствующий металл и выделяется водород. Например, при взаимодействии водорода с оксидом меди образуется металлическая медь и выделяется водород:
CuO + H2 → Cu + H2O
Такие реакции также нашли применение в промышленности, например, для получения меди из ее оксидов.
3. Реакция водорода с кислородными кислотами:
В реакциях водорода с кислородными кислотами образуется соответствующая соль и выделяется водород. Например, при взаимодействии водорода с серной кислотой образуется сернистая кислота и выделяется водород:
H2SO4 + 2H2 → H2SO3 + 2H2O
Эти реакции также могут использоваться для получения различных веществ, в том числе для получения сернистой кислоты или пероксидов.
4. Реакция водорода с азотными кислотами:
В реакциях водорода с азотными кислотами образуются азотные оксиды и выделяется водород. Например, при взаимодействии водорода с азотной кислотой образуется оксид азота (II) и выделяется водород:
4HNO3 + 3H2 → 2NO + NO2 + 4H2O
Такие реакции могут быть использованы для получения азотных оксидов, необходимых в различных индустриальных процессах.
Свойства водорода

1. Водород – самый легкий газ в природе. Его относительная молекулярная масса равна 2, то есть он в два раза легче воздуха. Благодаря этому свойству водород используется как заполнитель шаров и воздушных шаров.
2. Водород обладает низкой плотностью. Его газообразная форма характеризуется низкой плотностью, что делает его полезным в промышленности для получения легких материалов и составов.
3. Водород обладает высокой теплопроводностью. Он обладает способностью прекрасно проводить тепло, поэтому используется в различных отраслях промышленности, где требуется высокая эффективность передачи тепла.
4. Водород взрывоопасен при смешивании с кислородом или другими окислителями. Водород является очень легким газом и имеет высокую скорость сжигания, поэтому взрывоопасен при неправильном использовании или хранении.
5. Водород способен проявлять свои химические свойства, образуя соединения. Водород может образовывать соединения с различными элементами, такими как кислород, углерод, азот и другими. В результате образования соединений водород может использоваться в различных отраслях науки и промышленности.
Применение водорода в промышленности

1. Производство аммиака и удобрений:
Водород играет ключевую роль в производстве аммиака, который затем используется для производства удобрений. В промышленности часто используют процесс Хабера, в котором водород реагирует с азотом, образуя аммиак. Аммиак служит основным компонентом удобрений, таких как аммиачная селитра и карбамид, которые способствуют повышению урожайности растений.
2. Переработка нефти и газа:
Водород играет важную роль в процессе гидрогенизации, который используется для переработки нефти и газа. Гидрогенизация позволяет удалить необходимые компоненты из нефти и газа, такие как сера, при помощи реакции с водородом. Результатом этого процесса являются более чистые и экологически безопасные виды топлива, такие как бензин и дизельное топливо.
3. Производство металлов:
Водород также применяется в процессах производства некоторых металлов. Например, для производства нержавеющей стали водород используется в процессе деоксидации. Водород также используется при производстве подшипниковой стали и других видов металлов, которые требуют высокой чистоты и прочности.
4. Генерация электроэнергии:
Водород также используется в процессе генерации электроэнергии. Водородное топливо, такое как водородные топливные элементы, представляет собой чистое и эффективное источник энергии. Водородные топливные элементы используются в автомобилях, стационарных генераторах и других устройствах для производства электроэнергии без выделения вредных веществ и углекислого газа.
5. Водородная энергия и окружающая среда:
Применение водорода в промышленности также имеет потенциальное положительное влияние на окружающую среду. Водород может служить альтернативным источником энергии, который не производит загрязняющие вещества и не усугубляет проблему глобального потепления. Однако внедрение технологий водородной энергии в промышленность все еще ограничено из-за высоких затрат и сложностей в хранении и транспортировке водорода.
Вопрос-ответ

Как образуется водород из металлов?
Водород образуется из металлов во время реакции, называемой металлотермической реакцией. В результате этой реакции, металл вступает в контакт с кислым или влажным веществом, что приводит к образованию водорода.
Какая роль участвует в образовании водорода из металлов?
В образовании водорода из металлов участвуют два важных фактора: активность металла и наличие воды или кислоты. Металл должен быть достаточно активным, чтобы реагировать с водой или кислотой и образовывать водород.
Какие металлы могут образовывать водород?
Водород может образовываться из различных металлов, но наиболее активные металлы, такие как литий, натрий и калий, образуют водород более быстро и эффективно. Также, алюминий и цинк могут реагировать с кислотами и образовывать водород.
Какова химическая реакция при образовании водорода из металлов?
Химическая реакция при образовании водорода из металлов зависит от металла и вещества, с которым он реагирует. В общем случае, реакция между металлом и кислотой происходит по следующему уравнению: металл + кислота = соль + водород. Например, реакция между алюминием и серной кислотой приводит к образованию сульфата алюминия и водорода.
Как можно использовать образующийся водород из металлов?
Образующийся водород из металлов может быть использован в различных областях. Например, водород является очень эффективным источником энергии и может использоваться водородные топливные элементы для питания автомобилей и других устройств. Также, водород может быть использован в промышленности для производства различных химических соединений и синтеза аммиака.
