Металлы и вода - два вещества, которые обладают совершенно разными химическими свойствами. Однако, их взаимодействие может привести к интересным реакциям и образованию водорода. Различные металлы проявляют разную активность в реакции с водой.
Некоторые металлы, такие как натрий и калий, обладают высокой активностью и реагируют с водой уже при обычных условиях, выделяя большое количество водорода. При этом они могут даже воспламениться. Такие реакции широко используются в практических целях, например, при запуске ракет и в других химических процессах.
Другие металлы, например, алюминий, железо и цинк, также реагируют с водой, но при этом реакция происходит медленно и не так интенсивно. В периодической таблице элементов они расположены ближе к середине, что говорит о их средней активности. Они выделяют меньше водорода и могут образовать оксиды или гидроксиды.
Металлы, расположенные дальше от галогенов в периодической таблице элементов, реагируют с водой медленно или не реагируют вообще, так как они являются менее активными относительно воды. К ним относятся, например, серебро и золото.
Взаимодействие различных металлов с водой при обычных условиях - это сложный физико-химический процесс, изучение которого представляет интерес для науки и практики. Это позволяет разрабатывать новые материалы, применяемые в различных отраслях промышленности, и понимать глубинные законы химических реакций.
Металлы, способные реагировать с водой

Взаимодействие различных металлов с водой при обычных условиях может приводить к образованию водорода. Некоторые металлы способны активно реагировать с водой, при этом происходит выделение водорода и образование соответствующих оксидов металла.
Один из таких металлов – натрий (Na), который относится к щелочным металлам. При реакции натрия с водой образуется гидроксид натрия (NaOH) и выделяется водород (H2). Процесс реакции иногда происходит с достаточно сильным плаванием металла в воде.
Еще один металл, способный реагировать с водой, – калий (K). Реакция калия с водой подобна реакции натрия. Калий также образует гидроксид калия (KOH) и выделяет водород (H2).
Тантал (Ta) – это металл из группы переходных металлов. Он также может реагировать с водой, давая гидроксид тантала (Ta(OH)5) и выделяя водород (H2). Реакция тантала с водой, однако, более медленная, чем реакции щелочных металлов.
Следует отметить, что реактивность металлов с водой зависит от их положения в электрохимическом ряду. Чем выше металл находится в ряду, тем активнее он реагирует с водой. При этом активные металлы способны вытеснять ионы других металлов из их соединений с водой, вызывая электролитическую реакцию и образование водорода.
Условия, при которых происходит реакция металлов с водой

Реакция металлов с водой может происходить при обычных условиях, то есть при комнатной температуре и атмосферном давлении. Для того, чтобы реакция между металлом и водой произошла, необходимо наличие свободного водорода в системе.
В основе реакции металлов с водой лежит окислительно-восстановительный процесс, где металл окисляется, а вода восстанавливается. В результате реакции образуется оксид металла и молекулярный водород. Этот оксид металла далее может раствориться в воде и образовать соответствующие гидроксиды металлов.
Некоторые металлы, такие как натрий, калий и литий, очень реактивны и могут реагировать с водой даже в холодной воде. Однако большинство металлов, такие как железо, алюминий и цинк, обычно проявляют активность при нагревании воды. При этом температура воды влияет на скорость реакции: чем выше температура, тем быстрее происходит реакция.
Важно отметить, что не все металлы реагируют с водой. например, золото и платина не реагируют с водой при обычных условиях. Это связано с их химической инертностью и низкой активностью. Однако при определенных условиях, например, при наличии катализаторов или высоких температурах, эти металлы также могут взаимодействовать с водой и образовывать водород.
Химические свойства водорода
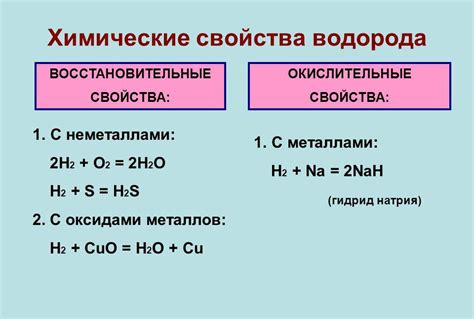
Водород является самым легким элементом в периодической таблице, обладающим атомным номером 1. Он образует одноимённый газ, который, благодаря низкому атомному весу и неполярности молекулы, обладает высокой плотностью энергии и обширно используется в различных областях промышленности.
Основным химическим свойством водорода является его способность реагировать с другими элементами до образования соединений. Вода, например, состоит из двух атомов водорода и одного атома кислорода (H2O). Водород также может реагировать с многими металлами, образуя гидриды.
Одним из важнейших свойств водорода является его способность к горению. Под воздействием источника зажигания, водород может воспламеняться и сгорать в присутствии кислорода, образуя воду. Это свойство делает водород полезным и эффективным источником энергии.
Кроме того, водород является химическим элементом, который обладает способностью проявлять свойства и аналогичные свойствам металлов, и свойства, свойственные неметаллам. Водород способен выступать в роли окислителя и восстановителя, что делает его важным компонентом в различных реакциях и процессах.
Водород также может образовывать взаимодействия с различными химическими компонентами, такими как кислоты и основания. Он может растворяться во многих веществах, включая металлы и неметаллы.
Важность образования водорода для промышленности

Образование водорода при взаимодействии различных металлов с водой является процессом, имеющим огромное значение для промышленной сферы. Водород, как химический элемент, является важным сырьем для многих отраслей промышленности.
Первым и наиболее распространенным применением водорода в промышленности является его использование в качестве сырья для производства аммиака. Аммиак широко применяется в производстве удобрений, пластиков, кожи и других продуктов. Образование водорода играет ключевую роль в процессе синтеза аммиака по Хаберу, где он выступает в качестве восстановителя и действует на катализатор.
Водород имеет также важное применение в производстве электролизного железа, которое используется для получения стали. Он служит восстанавливающим агентом, удаляя кислород из железной руды при взаимодействии с катализатором. Этот процесс осуществляется с помощью электричества, поэтому наличие водорода необходимо для электролиза.
Кроме того, водород играет важную роль в процессе производства металлургического кокса. Водород используется для улавливания и удаления вредных газов, таких как сероводород, из сырой нефти и газа. Водород, подаваемый в специальные установки, связывает эти газы, образуя безопасные соединения, что снижает экологическую нагрузку на окружающую среду.
Также водород используется в нефтеперерабатывающей промышленности для отбеливания и деароматизации нефтепродуктов, а также в процессе фильтрации и осаждения катализаторов.
В общем, образование водорода при взаимодействии различных металлов с водой играет ключевую роль в различных отраслях промышленности. Это важный химический процесс, обеспечивающий сырье для производства аммиака, электролизного железа, металлургического кокса и других продуктов, необходимых для удовлетворения потребностей промышленности.
Взаимодействие алкалий и щелочноземельных металлов с водой

Алкалии и щелочноземельные металлы, такие как литий, натрий, калий, магний и кальций, взаимодействуют с водой при обычных условиях. Данное взаимодействие приводит к образованию водорода и образованию оснований.
Взаимодействие алкалий с водой происходит очень активно и с выделением большого количества энергии. Металлы реагируют с водой, образуя соответствующие гидроксиды и выделяя водородный газ. Например, литий реагирует с водой по следующему уравнению:
2Li + 2H2O → 2LiOH + H2
Взаимодействие щелочноземельных металлов с водой происходит менее активно по сравнению с алкалиями. Однако они также образуют соответствующие гидроксиды и выделяют водородный газ. Например, взаимодействие магния с водой может быть представлено следующим уравнением:
Mg + 2H2O → Mg(OH)2 + H2
Получающиеся гидроксиды алкалий и щелочноземельных металлов являются сильными основаниями и растворяются в воде, образуя щелочные растворы. Водород, выделяющийся при реакции, обычно взрывоопасен и легко воспламеняется на воздухе.
Взаимодействие платиновых металлов с водой

Вода является уникальным растворителем, способным взаимодействовать с различными веществами. Платиновые металлы, такие как платина, палладий и родий, обладают уникальными свойствами, позволяющими им взаимодействовать с водой при обычных условиях.
Взаимодействие платиновых металлов с водой происходит при образовании химических соединений, которые могут быть полезными в различных областях науки и техники. Например, платина используется в процессе каталитического окисления водорода, где она выполняет роль катализатора, ускоряя химическую реакцию.
Однако, взаимодействие платиновых металлов с водой также может привести к образованию водорода. Платина может служить анодом в электрохимической реакции разложения воды на водород и кислород. В результате этой реакции, на платиновом электроде образуется водородный пузырь, который в последствии отрывается и выходит в виде газа.
Таким образом, взаимодействие платиновых металлов с водой является важным исследовательским объектом, которое помогает понять особенности химических процессов и разработать новые технологии. Платиновые металлы с их уникальными свойствами оказывают значительное влияние на различные области науки, включая катализ, электрохимию и физику поверхности.
Реакция алюминия с водой и ее применение

Алюминий — это реакционно способный металл, который активно взаимодействует с водой при обычных условиях. При контакте с водой на поверхности алюминия образуется оксид, который защищает металл от дальнейшего коррозийного взаимодействия с водой.
Реакция алюминия с водой приводит к образованию водорода. При этом происходит освобождение значительного объема газа, что делает эту реакцию довольно заметной и эффектной. Водород, выделяющийся при взаимодействии алюминия с водой, можно также использовать в различных промышленных и научных целях.
Применение водорода, образующегося при реакции алюминия с водой, разнообразно:
- Водород является ценным энергетическим ресурсом. Он может быть использован как источник энергии для топливных элементов или в процессе сжигания в водородных двигателях, что позволяет получить чистую и экологически безопасную энергию.
- Водород используется в химической промышленности в качестве синтезного газа и сырья для получения различных химических соединений.
- Водород может быть использован в процессе производства металлов, включая производство стали и никеля.
- Водород широко применяется в аналитической химии, а также при производстве стекла и полупроводников.
- Водород может использоваться в качестве пропелланта для ракет и воздушных судов.
Таким образом, реакция алюминия с водой и образование водорода имеют широкое применение в различных областях, включая энергетику, химическую промышленность, металлургию и аналитическую химию.
Вопрос-ответ

Какие металлы образуют водород при взаимодействии с водой?
Металлы, такие как натрий, калий, литий, цезий, рубидий и стронций, образуют водород при взаимодействии с водой.
Что происходит при взаимодействии металлов с водой?
При взаимодействии металлов с водой происходит реакция, в результате которой образуется водород и соответствующий гидроксид металла.
Почему при взаимодействии с водой образуется водород?
При взаимодействии металлов с водой происходит окислительно-восстановительная реакция, в результате которой металл окисляется, а вода восстанавливается. Гидроксид металла образуется в результате окисления металла, а водород выделяется в газообразном состоянии.
Какова роль воды в реакции образования водорода при действии металлов?
Вода в реакции образования водорода при действии металлов играет роль окислителя. Вода принимает электроны от металла, что приводит к образованию гидроксида металла и выделению водорода в газообразной форме.
