Химические реакции металлов с различными веществами – это один из основных объектов изучения химии. Взаимодействуя с различными реагентами, металлы могут проявлять себя как активные элементы, способные образовывать разнообразные соединения.
Контакт металлов с водой – одна из самых распространенных реакций. В результате этой реакции металл может выделять газы, изменять цвет воды или образовывать осадок. Когда металл контактирует с водой, происходит реакция окисления металла, за счет которой высвобождается водород, что хорошо видно по появлению пузырьков.
Реакция металлов с кислотами относится к классу реакций замещения, в результате которых металл вытесняет водород из кислоты. Некоторые металлы реагируют с кислотами активно, образуя соли и высвобождая газ. Другие металлы реагируют с кислотами менее активно и выделяют только водород. Реакция металла с кислотой может сопровождаться разогреванием, появлением газов или изменением цвета.
Контакт металлов с основаниями также сопровождается химической реакцией. В результате реакции металл может образовывать соли и выделять водород. Основания разнообразны и могут быть как неорганическими (например, щелочи), так и органическими (например, аминокислоты). Реакции металлов с основаниями важны для понимания их взаимодействия с живыми организмами и процессов, происходящих в них.
Реакция металлов с солями металлов, называемая также реакцией обмена, позволяет образовывать новые соединения металлов. В результате этой реакции металл замещает из раствора другой металл, образуя соль, а вытесненный металл выпадает в осадок. Реакция металлов с солями металлов является основой для получения различных материалов и сплавов, а также процессов химического анализа.
Реакции металлов с водой

Реакции металлов с водой – это процессы, в ходе которых металлы вступают в химическую реакцию с молекулами воды. При этом металлы могут проявлять различную активность в зависимости от их положения в ряду напряжений. Некоторые металлы, такие как литий, натрий и калий относятся к щелочным металлам и очень активно реагируют с водой.
При реакции с водой щелочные металлы выделяют водородный газ и образуют гидроксиды металлов. Например, литий исчезает в воде, образуя летящее пламя, а натрий реагирует с выделением пламени и образованием щелочи. В таких реакциях водородные ионы протекают через раствор и вызывают его щелочную реакцию.
Также существуют металлы, которые вступают в реакцию с водой лишь при нагревании. Например, железо или цинк реагируют с паром воды при высокой температуре. При этом металлы окисляются водой, а вместе с молекулами воды выделяется водородный газ.
Однако есть и металлы, которые не реагируют с водой. К ним относятся, например, серебро или золото. Эти металлы не образуют гидроксиды и не выделяют водородный газ в ходе реакции со водой. Поэтому они называются неподвижными металлами.
Химические реакции металлов с кислотами
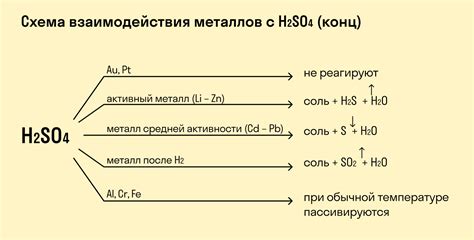
Металлы проявляют активность в химических реакциях с кислотами, образуя соли и выделяя водород. В зависимости от активности металла и его степени реакционной способности, скорость и интенсивность данной реакции могут существенно различаться.
Наиболее реакционно активные металлы, такие как щелочные и щелочноземельные металлы, реагируют с кислотами с выделением пузырьков водорода и образованием соответствующих солей. Например, реакция натрия с соляной кислотой приводит к образованию хлорида натрия и выделению водорода:
2Na + 2HCl → 2NaCl + H2
Более инертные металлы, например, железо или цинк, требуют более концентрированных или окисляющих кислот для проявления реакции. Например, реакция железа с серной кислотой приводит к образованию сульфата железа и выделению водорода:
Fe + H2SO4 → FeSO4 + H2
Однако, реактивность металлов с кислотами может быть не только сильной, но и опасной. Некоторые металлы, такие как алюминий или магний, способны реагировать с некоторыми кислотами с высокой интенсивностью и выделением большого количества водорода, что может привести к взрывам и пожарам. Поэтому, необходимо быть осторожными и следовать правилам безопасности при проведении таких экспериментов.
Взаимодействие металлов с основаниями

Металлы могут образовывать соединения с основаниями, так как они обладают щелочными свойствами. Основания представляют собой вещества, которые в растворе выделяют гидроксиды и обладают щелочными свойствами. Реакция металлов с основаниями протекает с образованием солей и выделением воды.
Во время взаимодействия металлов с основаниями происходит образование гидроксидов металлов - солей, состоящих из катиона металла и аниона гидроксида. Например, при взаимодействии натрия с гидроксидом натрия образуется соль - натрия гидроксида (NaOH), а при взаимодействии алюминия с гидроксидом алюминия образуется соль - алюминия гидроксида (Al(OH)3).
В процессе взаимодействия металлов с основаниями обычно происходит выделение воды. Выделение воды в реакции металлов с основаниями связано с тем, что при реакции происходит образование воды в результате соединения ионов гидроксида и водорода.
Реакция металлов с основаниями может иметь промышленное применение. Например, в процессе производства щелочи, такой как гидроксид натрия (NaOH) или гидроксид калия (KOH), используется реакция натрия или калия с соответствующим гидроксидом. Эти реакции позволяют получить щелочи, которые в дальнейшем используются в различных отраслях промышленности.
Реакции металлов с солями металлов

Реакции металлов с солями металлов являются одной из разновидностей одноэтапных реакций. В ходе таких реакций ион металла замещает в растворе ион другого металла. Данный процесс может происходить в виде обмена или двойного разложения в зависимости от условий реакции.
При обмене взаимодействуют две пары соляных металлов, при этом ионы реагирующих металлов перемешиваются и образуют новые соединения. Например, при реакции цинка с медным нитратом образуется цинковый нитрат и медь:
Zn + CuNO32 → Zn(NO3)2 + Cu
Двойное разложение происходит при взаимодействии двух солей, растворы которых содержат ионы реагирующих металлов. В результате данной реакции образуются два новых соединения, которые осаждаются или растворяются. Например, при реакции нитрата свинца и хлорида железа образуется осадок железа(III) оксида и растворяющийся нитрат железа (III):
Pb(NO3)2 + 2FeCl3 → 2FeO + PbCl2 + 2NO2 + O2
Реакции металлов с солями металлов часто используются в лаборатории для определения присутствия или концентрации определенного металла в растворе. Они также являются важной составляющей в области химических анализов.
Химические свойства металлов в реакциях с водой, кислотами, основаниями и солями металлов
Реакции металлов с водой:
Многие металлы обладают возможностью взаимодействовать с водой, образуя гидроксиды и высвобождая при этом водород. Часть металлов, таких как натрий, калий и литий, реагируют с водой очень активно, наблюдается яркое пламя и выделение водорода. Другие металлы, например, железо или цинк, реагируют с водой медленно, но непрерывно, выделяя также водород.
Реакции металлов с кислотами:
Металлы могут взаимодействовать с кислотами, образуя соли и выделяя водород. Так, например, цинк и серная кислота образуют сульфат цинка, алюминий и соляная кислота - хлорид алюминия. Во время реакции между металлом и кислотой, наблюдается выделение пузырьков газа и изменение цвета реакционной смеси.
Реакции металлов с основаниями:
Многие металлы реагируют с основаниями, образуя соли и высвобождая водород. Например, натрий и гидроксид натрия образуют хлорид натрия и воду. Реакция между металлом и основанием сопровождается наблюдением пузырьков газа и образованием новой вещественной формы - соли.
Реакции металлов с солями металлов:
Реакция между металлом и солями металлов протекает с образованием нового соединения - металлического отложения. Например, медь и сернокислый раствор меди образуют медь. Процесс можно подтвердить изменением цвета раствора и образованием осадка.
Влияние металлов на окружающую среду

Металлы имеют значительное влияние на окружающую среду, как в естественной, так и в промышленной среде. Одним из основных факторов, влияющих на окружающую среду, является выброс металлов в атмосферу в виде паров и пыли. Это происходит в процессе сгорания топлива, металлургического производства и других промышленных операций.
Особенно неблагоприятное воздействие на окружающую среду оказывают тяжелые металлы, такие как свинец, ртуть, кадмий и цинк. Они могут накапливаться в почве, воде и живых организмах, вызывая серьезные нарушения в экосистеме и вредя здоровью человека. Например, свинец и ртуть могут вызывать отравления, повреждение нервной системы и мозга, а кадмий - онкологические заболевания.
Металлы также влияют на водные ресурсы. Выбросы металлов в реки и озера приводят к загрязнению воды и угрозе для рыбы и других водных организмов. Особенно это касается ртутных соединений, которые накапливаются в организмах рыб и могут нанести вред как для животных, так и для людей, которые употребляют рыбу в пищу.
Важно отметить, что промышленные выбросы не являются единственным источником металлов в окружающей среде. Распад и сгорание отработанных продуктов, утилизация отходов, использование удобрений и пестицидов также вносят свой вклад в загрязнение металлами. Поэтому контроль и ограничение выбросов металлов должны быть основными задачами в сфере охраны окружающей среды.
Вопрос-ответ

Что происходит при взаимодействии металлов с водой?
При взаимодействии некоторых металлов с водой происходят химические реакции. Например, алюминий реагирует с водой по следующему уравнению: 2Al + 6H2O = 2Al(OH)3 + 3H2. В результате образуется оксид металла или его гидроксид и выделяется водород. Некоторые металлы, такие как магний и цинк, реагируют с водой только при нагревании.
Как происходят химические реакции металлов с кислотами?
Химические реакции металлов с кислотами протекают по типу замещения водорода в молекуле кислоты. Например, реакция железа с серной кислотой протекает по следующему уравнению: Fe + H2SO4 = FeSO4 + H2. В результате образуется соединение металла и выделяется водород. Некоторые металлы, такие как золото и платина, не реагируют с кислотами.
Как происходят химические реакции металлов с основаниями?
Химические реакции металлов с основаниями протекают по типу замещения металла в молекуле основания. Например, реакция натрия с гидроксидом натрия протекает по следующему уравнению: 2Na + 2NaOH = 2Na2O + H2. В результате образуется оксид металла и выделяется водород. Некоторые металлы, такие как медь и ртуть, не реагируют с основаниями.
Как происходят химические реакции металлов с солями металлов?
Химические реакции металлов с солями металлов протекают по типу замещения металла в молекуле соли. Например, реакция цинка с сернокислым цинком протекает по следующему уравнению: Zn + ZnSO4 = 2ZnO + SO2. В результате образуется оксид металла и выделяется диоксид серы. Некоторые металлы, такие как серебро и платина, не реагируют с солями металлов.
