Взаимодействие металлов с солью другого металла является важной темой в химии и материаловедении. Оно становится особенно интересно при рассмотрении реакций между различными металлами и их соединениями. Такие реакции могут иметь различные особенности и приводить к образованию новых веществ, обладающих уникальными свойствами.
Одной из особых особенностей взаимодействия металлов с солью другого металла является возможность проведения реакций, которые приводят к образованию сплавов. Сплавы представляют собой гомогенные смеси из нескольких металлов и обладают новыми свойствами, отличными от свойств исходных веществ. Наиболее известными примерами таких сплавов являются бронза (медь и олово) и латунь (медь и цинк).
Взаимодействие металлов с солью другого металла также может приводить к образованию осадков. При проведении реакций в растворе металлических солей, часто наблюдаются выпадения нерастворимых соединений. Эти осадки могут обладать различными свойствами и структурами, что делает их интересными для изучения и применения в различных областях науки и техники.
Электрохимическое взаимодействие
Электрохимическое взаимодействие металлов с солью другого металла базируется на принципе передачи электронов между различными металлическими элементами. Когда металл погружается в раствор соли другого металла, происходит диссоциация соли на ионы иобразуются две половинки реакции: окисление металла и восстановление иона металла.
В процессе электрохимического взаимодействия металлов с солью другого металла возникает электрохимическая ячейка. В данной ячейке происходят окислительно-восстановительные реакции на электроде, в результате которых один металл окисляется, а другой восстанавливается. При этом на электроде, на котором происходит окисление металла, образуется электронный поток, который имеет направление от металла с более высоким потенциалом окисления к металлу с более низким потенциалом окисления.
Электрохимическое взаимодействие металлов с солью другого металла связано с образованием электродных потенциалов. При этом каждый металл имеет свое характерное значение электродного потенциала, которое зависит от его химической природы и физических свойств. Чем ближе значения электродных потенциалов металлов, тем слабее проявляется их химическая активность при взаимодействии с солью другого металла.
В результате электрохимического взаимодействия металлов с солью другого металла может образоваться покрытие на поверхности металла, которое предотвращает его окисление и коррозию. Такие покрытия называются защитными или наносистемами. Защитные покрытия могут быть различной природы, например, оксидами, гидроксидами, солевыми осадками и т.д. Они образуются в результате реакций между ионами металла и ионами солей в растворах.
Образование ионов и соединений
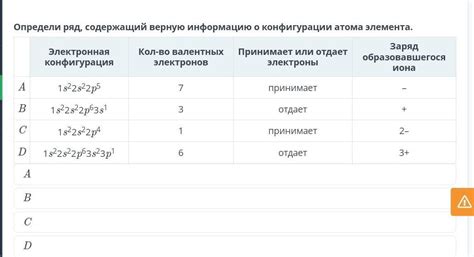
Взаимодействие металлов с солью другого металла приводит к образованию ионов и соединений. Между металлом и солью происходит реакция, в результате которой металл отдает электроны, превращаясь в положительно заряженный ион.
Соль, в свою очередь, принимает эти электроны, превращаясь в отрицательно заряженный ион. Таким образом, образуются ионы, которые притягиваются друг к другу и образуют ионное соединение.
Образование ионов и соединений при взаимодействии металлов с солью другого металла зависит от электрохимической активности данных металлов. Металлы с большей электрохимической активностью имеют большую склонность отдавать электроны и образовывать положительно заряженные ионы.
В реакции между металлом и солью другого металла возможно образование различных ионов и соединений. Например, при взаимодействии цинка с раствором медного купороса образуется ион цинка Zn²⁺ и ион меди Cu²⁺, а также осадок медного гидроксида.
Окислительно-восстановительные реакции
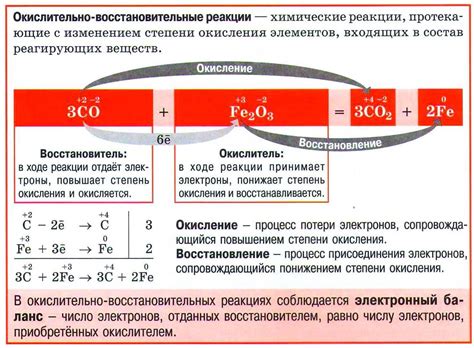
Взаимодействие металлов с солью другого металла может протекать в рамках окислительно-восстановительных реакций. Эти реакции связаны с передачей электронов между металлами и солями. Окислитель принимает электроны, становясь восстановителем, в то время как восстановитель отдает электроны, становясь окислителем.
В таких реакциях металл может окислиться, теряя электроны, а соль может восстановиться, приобретая электроны. Процесс окисления металла обычно сопровождается образованием ионов металла в растворе, в то время как восстановление соли связано с образованием металлического осадка.
Примером окислительно-восстановительной реакции может служить взаимодействие медной проволоки с раствором серебряной соли. При этом медь окисляется, образуя ионы меди в растворе, а серебро восстанавливается, сформировав металлические осадки на поверхности меди.
- Основные принципы окислительно-восстановительных реакций:
- Передача электронов между металлом и солью;
- Изменение степени окисления металла;
- Образование ионов металла в растворе и/или образование металлического осадка;
- Образование ионов восстановленной/окисленной соли.
В результате окислительно-восстановительных реакций возникают новые вещества и изменяется состояние металла и соли. Эти реакции имеют значительное значение в химической и гальванической энергетике, а также в многих других областях науки и техники.
Коррозия и защита металлов

Коррозия – процесс разрушения металла под воздействием окружающей среды. Он приводит к уменьшению массы и механической прочности металла, что может стать серьезной проблемой в различных отраслях промышленности и строительства.
Первопричины коррозии – взаимодействие металла с влагой и кислородом воздуха. В результате этого процесса на поверхности металла образуются оксиды и гидроксиды, которые способствуют разрушению структуры металла.
Для защиты металлов от коррозии существует несколько методов. Один из них – покрытие металла защитными слоями. Это может быть нанесение защитного оксида путем окисления металла или использование специальных противокоррозионных покрытий, таких как краска или эпоксидные смолы.
Еще один способ защиты – использование правильной селекции материала. Это означает выбор металла, который будет иметь высокую стойкость к коррозии в заданных условиях эксплуатации.
Кроме того, используются методы активной защиты металлов от коррозии, такие как катодная защита и использование антикоррозионных добавок в окружающей среде.
В итоге, правильная защита металлов от коррозии позволяет сохранить их работоспособность и долговечность, а также обеспечить безопасность и эстетический вид изделий и конструкций из металла.
Вопрос-ответ

Какие металлы можно использовать для взаимодействия с солью другого металла?
Для взаимодействия с солью другого металла можно использовать различные металлы, такие как цинк, железо, алюминий, медь и другие.
Какие особенности имеет взаимодействие металлов с солью другого металла?
Взаимодействие металлов с солью другого металла может привести к реакциям окисления-восстановления, образованию осадков или сплавов. Кроме того, можно наблюдать изменение цвета раствора или образование пузырьков газа.
Какие реакции могут происходить при взаимодействии металлов с солью другого металла?
При взаимодействии металлов с солью другого металла могут происходить различные реакции, включая замещение одного металла другим в растворе, образование осадков или сплавов, а также реакции окисления-восстановления. Например, если поместить кусок цинка в раствор серной кислоты, произойдет реакция, при которой цинк будет замещать водород в молекуле кислоты, образуя сульфат цинка и выделяя газ водород.
