Соляная кислота (HCl) – одна из наиболее распространенных и важных неорганических кислот. Взаимодействие соляной кислоты с металлами – один из фундаментальных объектов изучения химических реакций. Это взаимодействие имеет особое значение в различных областях, таких как промышленность, лабораторные исследования и даже повседневная жизнь. В данной статье будут рассмотрены примеры и реакции взаимодействия металлов с соляной кислотой.
Первоначально, стоит отметить, что взаимодействие металлов с соляной кислотой включает в себя ряд химических процессов, которые могут привести к образованию газов, соединений и других продуктов реакции. Каждый металл может обладать своей специфической реакцией с соляной кислотой, основанной на его химических свойствах и реакционной активности.
Примеры взаимодействия металлов с соляной кислотой включают реакцию алюминия (Al) с соляной кислотой, что приводит к выделению газа водорода (H2) и образованию соли алюминия (AlCl3). Кроме того, железо (Fe) может реагировать с соляной кислотой, образуя водород и соль железа(II) хлорида (FeCl2). Также стоит упомянуть о реакции цинка (Zn) с соляной кислотой, при которой образуются водород и соль цинка(II) хлорида (ZnCl2).
Исследования взаимодействия металлов с соляной кислотой позволяют не только лучше понять химические реакции, происходящие между ними, но и находить применение этих реакций в различных областях науки и технологии. Расширение знаний о взаимодействии металлов с соляной кислотой имеет большое практическое значение и способно привести к созданию новых материалов, улучшению производственных процессов и развитию новых технологий.
Взаимодействие металлов

Металлы — это химические элементы, обладающие хорошей проводимостью тепла и электричества, а также имеющие металлический блеск и способность образовывать положительные ионы.
Металлы могут взаимодействовать с различными веществами и проявлять свои химические свойства. Одним из таких веществ является соляная кислота — химическое соединение, состоящее из водорода и хлора (HCl).
Взаимодействие металлов с соляной кислотой протекает по реакции образования соли и выделения водорода. В результате этой реакции образуется хлорид металла и освобождается водородный газ. Реактивность металлов в этой реакции зависит от их электрохимического потенциала. Например, металлы, находящиеся выше в ряду электрохимического ряда, более реактивны и быстро реагируют с соляной кислотой.
Примерами металлов, которые взаимодействуют с соляной кислотой, являются цинк (Zn), железо (Fe), алюминий (Al), медь (Cu) и свинец (Pb). Реакция взаимодействия этих металлов с соляной кислотой может быть представлена следующим образом:
| Металл | Реакция с соляной кислотой |
|---|---|
| Цинк (Zn) | Zn + 2HCl → ZnCl2 + H2 |
| Железо (Fe) | Fe + 2HCl → FeCl2 + H2 |
| Алюминий (Al) | 2Al + 6HCl → 2AlCl3 + 3H2 |
| Медь (Cu) | 2Cu + 4HCl → 2CuCl2 + H2 |
| Свинец (Pb) | Pb + 2HCl → PbCl2 + H2 |
Таким образом, взаимодействие металлов с соляной кислотой является одной из химических реакций, которая позволяет наблюдать проявление свойств металлов и получение соединений металлов с солями.
Механизм взаимодействия

Взаимодействие металлов с соляной кислотой основано на химической реакции, которая происходит в результате контакта этих веществ. Соляная кислота (HCl) является сильным представителем минеральных кислот и обладает высокой степенью диссоциации в водном растворе. Это позволяет ей эффективно вступать во взаимодействие с металлами.
Контакт соляной кислоты с металлом приводит к образованию соли металла и выделению водорода. Это связано с тем, что HCl диссоциирует на ионы водорода (H+) и ионы хлоридов (Cl-). Ионы водорода реагируют с металлической поверхностью, образуя нейтральные атомы, которые затем присоединяются к соли металла, образуя водорастворимую соль. В результате происходит выпадение осадка соли металла из раствора.
Сам процесс взаимодействия метала со соляной кислотой может проходить в несколько этапов. Начальный этап – адсорбция и диссоциация соляной кислоты на поверхности металла. Затем происходит процесс реакции ионов водорода с металлом, сопровождающийся выделением газообразного водорода. Эти реакции являются экзотермическими, то есть сопровождаются выделением тепла.
При взаимодействии различных металлов с соляной кислотой могут происходить различные реакции. Некоторые металлы, такие как ртуть (Hg) и платина (Pt), не реагируют с соляной кислотой. Некоторые металлы реагируют с выделением газообразного хлора (Cl2), например, медь (Cu). Другие металлы реагируют с выделением газообразного сероводорода (H2S), как, например, свинец (Pb) и цинк (Zn). Это связано с разными кинетическими свойствами различных металлов и их способностью эффективно взаимодействовать с ионами водорода и хлоридами.
Полярность молекулы
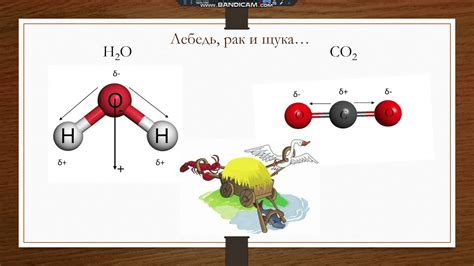
Полярность молекулы - это характеристика, определяющая разделение электрического заряда внутри молекулы. В полярной молекуле центры положительного и отрицательного зарядов не совпадают и образуют диполь. Полярность обусловлена неравномерным распределением электронной плотности и разницей в электроотрицательности атомов.
Полярные молекулы взаимодействуют с полярными растворителями, такими как вода или соляная кислота. Взаимодействие молекулы с полярным растворителем происходит по принципу "подобное растворяется в подобном". Из-за различия в электрическом заряде молекулы могут образовывать водородные связи или слабые кулоновские силы притяжения с полярными растворителями, что обуславливает их растворимость.
Полярные молекулы также могут взаимодействовать между собой через межмолекулярные силы, такие как диполь-дипольное взаимодействие или водородные связи. Эти силы обеспечивают структуру многих веществ и влияют на их физические свойства, например на температуру плавления или кипения.
Неполярные молекулы не имеют разделенных электрических зарядов и не образуют диполь. Они обладают низкой или отсутствующей растворимостью в полярных растворителях, так как недостаточно взаимодействуют с полярными молекулами растворителя.
Соляная кислота

Соляная кислота, также известная под названием хлороводородная кислота, является одним из наиболее распространенных кислотных соединений и широко используется в промышленности и научных исследованиях. Она представляет собой бесцветную жидкость с едким запахом, обладающую высокой степенью коррозийности.
Соляная кислота образуется путем растворения хлора в воде. Ее основное свойство - являться сильной кислотой, то есть образовывать положительные ионные формы водорода (H+) в водном растворе.
Кроме использования в промышленности, соляная кислота также используется в лабораторных условиях как реагент и аналитическое вещество. Она может использоваться для очистки и обезжиривания металлов перед их обработкой или соединениями.
Одним из наиболее известных примеров реакции соляной кислоты с металлами является реакция с железом, при которой образуется водород и хлорид железа:
- Fe + 2HCl → FeCl2 + H2
Реакция между соляной кислотой и металлами происходит взаимодействия молекулы кислоты с поверхностью металла, что приводит к образованию ионных соединений и выделению водорода.
В целом, взаимодействие металлов с соляной кислотой является важным физико-химическим процессом, который имеет широкие применения в различных областях науки и промышленности.
Основные свойства

Металлы обладают рядом характерных свойств, которые влияют на их взаимодействие с соляной кислотой. Во-первых, металлы обладают высокой электропроводностью, что объясняется наличием свободных электронов в их кристаллической решетке. Электронные облака металла позволяют электрическому току свободно передвигаться по его структуре.
Во-вторых, металлы имеют грандиозную прочность, что делает их идеальными материалами для построения различных конструкций и механизмов. Прочность металлов обусловлена их специфической кристаллической структурой, состоящей из регулярно расположенных атомов, что позволяет им выдерживать большие механические нагрузки.
Кроме того, металлы хорошо отражают свет и тепло, что связано с их определенной электронной структурой и способностью свободных электронов поглощать и переизлучать энергию. Именно из-за этих свойств металлы используются для создания зеркал, отражающих поверхностей и нагревательных элементов.
Еще одним важным свойством металлов является их способность взаимодействовать с различными химическими соединениями, в том числе соляной кислотой. В результате этого взаимодействия возникают экзотермические реакции, сопровождающиеся выделением тепла и образованием новых веществ. Такие реакции можно наблюдать при взаимодействии металлов с соляной кислотой.
Кислотность и pH
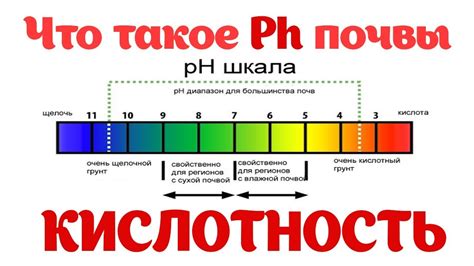
Кислотность - это характеристика растворов, которая определяется их содержанием ионов водорода (H+). Чем больше ионов H+ в растворе, тем кислее он является. Обратная характеристика - щелочность, определяется содержанием ионов гидроксида (OH-) в растворе.
pH - это числовая шкала, которая измеряет уровень кислотности или щелочности раствора. pH 7 соответствует нейтральному раствору, pH ниже 7 указывает на кислотность, а pH выше 7 указывает на щелочность. Более низкое значение pH означает более кислотный раствор, а более высокое значение pH означает более щелочной раствор.
Измерение pH осуществляется с помощью pH-метра или специальных тест-полосок. pH-метр измеряет электрическое напряжение, образующееся в результате реакции между ионами раствора и электродом. Тест-полоски содержат индикаторные вещества, которые меняют цвет в зависимости от pH раствора.
Человеческий организм имеет определенный pH для нормального функционирования. Кровь и другие телесные жидкости обычно имеют слабощелочную реакцию с pH около 7,4. Изменения уровня pH могут привести к нарушениям в работе органов и тканей. Кислая или щелочная реакция может вызвать различные заболевания и нарушения химических процессов в организме.
Примеры взаимодействия

1. Реакция меди с соляной кислотой: Медь (Cu) реагирует с соляной кислотой (HCl) с образованием хлорида меди (CuCl2) и выделением газообразного водорода (H2). Уравнение реакции выглядит следующим образом:
Cu + 2HCl → CuCl2 + H2
2. Реакция цинка с соляной кислотой: Цинк (Zn) также реагирует с соляной кислотой (HCl), образуя хлорид цинка (ZnCl2) и выделяя водород (H2):
Zn + 2HCl → ZnCl2 + H2
3. Реакция железа с соляной кислотой: Железо (Fe) при контакте с соляной кислотой (HCl) формирует хлорид железа (FeCl2) и выделяет водород (H2):
Fe + 2HCl → FeCl2 + H2
4. Реакция алюминия с соляной кислотой: Алюминий (Al) реагирует с соляной кислотой (HCl), образуя хлорид алюминия (AlCl3) и выделяя водород (H2):
2Al + 6HCl → 2AlCl3 + 3H2
5. Реакция свинца с соляной кислотой: Свинец (Pb) реагирует с соляной кислотой (HCl), образуя хлорид свинца (PbCl2) и выделяя газообразный водород (H2):
Pb + 2HCl → PbCl2 + H2
Медь и соляная кислота

Медь является одним из металлов, которые активно реагируют с соляной кислотой. При взаимодействии меди с соляной кислотой происходит окислительно-восстановительная реакция, в результате которой образуется растворимая соль меди и выделяется газ.
Реакция между медью и соляной кислотой описывается следующим уравнением:
2HCl + Cu -> CuCl2 + H2
В результате реакции образуется хлорид меди (II) и выделяется молекулярный водород. Соль меди, образовавшаяся в результате реакции, растворяется в воде, образуя ионный раствор.
Разумеется, реакция протекает только при наличии соляной кислоты и достаточного количества меди. Чем больше меди присутствует, тем больше соли меди образуется.
Важно отметить, что взаимодействие меди с соляной кислотой является химической реакцией с выделением газа. Эту реакцию можно использовать для демонстрации присутствия соляной кислоты или в качестве способа получения соли меди.
Вопрос-ответ

Какие металлы реагируют с соляной кислотой?
С соляной кислотой реагируют металлы, находящиеся выше в ряду активности, чем водород. Примерами таких металлов являются цинк (Zn), железо (Fe), медь (Cu), алюминий (Al) и др.
Какая реакция происходит при взаимодействии металлов с соляной кислотой?
При взаимодействии металлов с соляной кислотой происходит реакция образования солей и выделения водорода. В общем виде реакция выглядит следующим образом: металл + соляная кислота = соль + водород. Например, реакция цинка с соляной кислотой выглядит так: Zn + 2HCl = ZnCl2 + H2.
Какие факторы могут влиять на скорость реакции металлов с соляной кислотой?
Скорость реакции металлов с соляной кислотой может зависеть от таких факторов, как концентрация соляной кислоты, поверхность металла, температура окружающей среды и наличие катализаторов. Например, при повышении концентрации соляной кислоты скорость реакции обычно увеличивается.
Какие свойства и применения у солей, полученных при реакции металлов с соляной кислотой?
Соли, полученные при реакции металлов с соляной кислотой, обладают различными свойствами и могут использоваться в различных отраслях. Например, хлорид цинка (ZnCl2) используется в гальванике, железо(III) хлорид (FeCl3) применяется в процессе катализа, алюминий хлорид (AlCl3) используется в качестве катализатора в химической промышленности.
