Металлы - это одна из основных групп химических элементов, которая обладает свойствами, присущими только им. Они образуют соли, обладают высокой электропроводностью, хорошей теплопроводностью и способностью отдавать электроны в реакциях. Реакции металлов с солями представляют собой важный аспект их взаимодействия с другими веществами.
Металлы могут реагировать с солями различными способами. Некоторые металлы, такие как железо или алюминий, способны вытеснять из растворов свои ионные соединения солями с более низкой электроотрицательностью. Это обусловлено тем, что металлы имеют способность отдавать электроны и образовывать более устойчивые ионы.
Реакции металлов с солями могут протекать с образованием осадка. Например, при взаимодействии хлорида свинца(II) с хлоридом натрия происходит образование нерастворимого хлорида свинца(II), что приводит к выпадению осадка. Кроме того, реакции металлов с солями могут сопровождаться выделением газов, изменением цвета или образованием комплексных соединений.
Химические реакции металлов с солями

Металлы проявляют способность к реакциям с солями, что позволяет использовать их в различных процессах химической промышленности. Реакция металлов с солями основана на обмене ионами между металлом и солью, приводящей к образованию новых веществ.
Реакция окисления является одной из наиболее распространенных реакций металлов с солями. В этом случае металл выступает в роли окислителя, принимая электроны от иона металла, который окисляется. Примером такой реакции является взаимодействие цинка с соляной кислотой:
- 2HCl + Zn → ZnCl2 + H2
Реакция замещения также часто наблюдается при взаимодействии металлов с солями. В результате этой реакции ион металла соли замещается ионом металла, который имеет более высокий степень окисления. Например, при реакции цинка с серной кислотой происходит замещение иона водорода:
- Zn + H2SO4 → ZnSO4 + H2
Реакция осаждения является специфическим видом реакции металлов с солями. В этом случае образуется осадок металла на поверхности, который можно использовать для различных целей. Например, при реакции цинка с раствором медного(II) сульфата образуется осадок меди:
- Zn + CuSO4 → ZnSO4 + Cu
Реакции металлов с солями имеют важное практическое значение и широко применяются в различных отраслях промышленности, таких как металлургия, электротехника и другие. На основе этих реакций разрабатываются методы получения и очистки металлов, а также производства электрохимических элементов и солевых соединений.
Факторы, влияющие на скорость взаимодействия

1. Вид металла. Скорость взаимодействия металла с солями зависит от его вида. Некоторые металлы реагируют с солями быстро и энергично, в то время как другие проявляют меньшую активность. Например, щелочные металлы, такие как натрий и калий, реагируют с солями очень быстро, в то время как некоторые переходные металлы могут иметь меньшую скорость реакции.
2. Концентрация соли. Чем выше концентрация соли, тем быстрее происходит взаимодействие с металлом. Это связано с тем, что частицы соли в растворе сталкиваются с поверхностью металла чаще при большей концентрации, что приводит к более интенсивной реакции.
3. Температура. Увеличение температуры также способствует увеличению скорости реакции металла с солями. При повышении температуры молекулы соли получают больше энергии, что способствует их активному столкновению с поверхностью металла.
4. Площадь поверхности металла. Чем больше площадь поверхности металла, тем больше места для взаимодействия с солями. Более мелкие частицы металла или металлическая порошкообразная структура создают большую поверхность, что увеличивает скорость реакции.
5. Наличие катализаторов. Некоторые вещества, называемые катализаторами, могут повысить скорость реакции металла с солями, не участвуя в реакции и не изменяя своей структуры. Катализаторы снижают энергию активации реакции, делая ее более быстрой и эффективной.
6. PH среды. Кислотная или щелочная среда может влиять на скорость реакции металла с солями. Некоторые металлы реагируют быстрее в кислой или щелочной среде, в то время как другие - в нейтральной. PH среды может изменить концентрацию водородных или гидроксильных ионов, что повлияет на скорость реакции.
Образование осадка при реакции
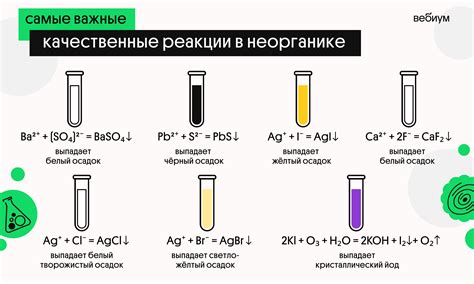
Образование осадка является важным аспектом реакции металлов с солями. В процессе взаимодействия металла с солью, образуется не растворимый вещество, которое выпадает в виде твердого осадка.
Такое образование осадка происходит при наличии химической реакции между металлом и солью. Когда металл вступает в реакцию с солью, происходит ионный обмен, в результате которого металлические ионы замещают ионы соли. Если образуется не растворимый продукт реакции, то он выпадает в виде осадка.
Образовавшийся осадок обычно имеет специфичные свойства, такие как цвет, текстуру и состав. Эти свойства зависят от вида металла и соли, а также от условий реакции. Благодаря этим свойствам осадок может быть идентифицирован и использован в химическом анализе для определения присутствия определенных ионов.
Важно отметить, что не все реакции между металлами и солями приводят к образованию осадка. Некоторые реакции могут быть обратимыми, и получившийся продукт растворяется в воде, оставляя прозрачный раствор без осадка. Такие реакции могут иметь различную скорость и зависеть от концентрации реагентов и условий реакции.
Образование осадка при реакции металлов с солями является очень важным фактором при изучении химии металлов и может применяться как в лабораторных условиях, так и в промышленности для получения различных веществ.
Возможные применения реакции металлов с солями

Реакция металлов с солями имеет широкие практические применения в различных сферах. Одно из главных применений этой реакции - получение металлов из их соединений. Многие металлы, такие как железо, медь, алюминий и цинк, получают в промышленных масштабах именно через реакцию с соответствующими солями.
Кроме получения металлов, реакция металлов с солями находит применение в процессах химического анализа. Например, для определения содержания металлов в различных образцах применяется метод атомно-абсорбционной спектрофотометрии. При проведении этого анализа используется реакция металлов с солями, которая позволяет получить вещества с определенной окраской, характерной для каждого металла. Измеряя интенсивность поглощения света в данном диапазоне, можно определить содержание металлов в образце.
Кроме того, в некоторых случаях реакция металлов с солями используется в медицине. Например, комплексы меди и других металлов с солями используются в качестве антимикробных веществ. Они обладают способностью инактивировать различные патогенные микроорганизмы и находят применение в лечении инфекционных заболеваний.
В заключение, реакция металлов с солями имеет множество важных применений в различных областях. От получения металлов до применения в аналитической химии и медицине, эта реакция играет значительную роль в нашей повседневной жизни и современных технологиях.
Особенности реакции различных металлов с солями

Взаимодействие металлов с солями является одним из самых важных процессов в химии. Реакция металлов с солями может протекать по разным механизмам и иметь разные характеристики, в зависимости от вида металла.
Одной из основных особенностей реакции является способность металлов к окислению. Многие металлы имеют высокую активность и способность отдавать электроны для образования положительно заряженных ионов. При этом соли металлов образуются путем реакции обмена, когда ионы металла замещают ионы водорода в соли.
Однако не все металлы могут взаимодействовать с солями одинаково. Некоторые металлы, такие как железо или цинк, обладают способностью к различным степеням окисления, что может повлиять на результат и характер реакции. В ряде случаев взаимодействие может протекать с выделением газа, например, при реакции алюминия с солями кислорода.
Также стоит отметить, что реакция металлов с солями может сопровождаться образованием осадков. Это происходит, когда реакция приводит к образованию нерастворимых веществ, которые выпадают в осадок. Образование осадков может зависеть от концентрации соли, pH среды и других факторов.
Изучение реакции металлов с солями позволяет получить ценные данные о взаимодействии различных веществ, а также использовать эти реакции в различных областях, таких как промышленность, медицина или экология. Поэтому данная тема имеет большое значение для понимания основ химических процессов и их применения в практике.
Вопрос-ответ

Какие металлы реагируют с солями?
С растворами солей реагируют большинство металлов, однако степень их реакции может существенно различаться.
Почему металлы реагируют с солями?
Как правило, металлы реагируют с солями, так как они обладают химической активностью, которая проявляется во взаимодействии с другими веществами, в том числе солями.
Какие металлы реагируют со солями наиболее интенсивно?
Наиболее интенсивно с солями реагируют щелочные металлы, такие как натрий и калий, а также ряд активных металлов, например, алюминий и цинк.
Какие продукты образуются солями при реакции с металлами?
При реакции металлов с солями образуются металлические соли, которые являются продуктами данной химической реакции.
Какие факторы могут влиять на скорость реакции металлов с солями?
Скорость реакции металлов с солями может зависеть от различных факторов, таких как концентрация раствора соли, температура окружающей среды, а также свойства самого металла.
