Одним из важных аспектов изучения химических реакций является взаимодействие металлов с различными соединениями. Особый интерес вызывает взаимодействие металлов с солями азотной кислоты, так как оно имеет многочисленные промышленные и научные приложения.
Металлы, взаимодействующие с солями азотной кислоты, могут проявлять различные химические реакции, включая окисление, выделение азота и образование нитратных соединений. В зависимости от условий реакции и свойств металла, результаты взаимодействия могут быть разными.
Стоит отметить, что некоторые металлы, такие как железо или цинк, могут реагировать с солями азотной кислоты с выделением азотного газа и образованием нитратов. Другие металлы, такие как алюминий или свинец, могут образовывать стабильные нитратные соединения, которые могут использоваться в промышленности или в научных целях.
Химические свойства солей азотной кислоты
Соли азотной кислоты обладают рядом уникальных химических свойств, благодаря которым они находят широкое применение в различных отраслях промышленности.
Прежде всего, соли азотной кислоты хорошо растворяются в воде, образуя хорошо проводящие электрический ток растворы. Это свойство делает их эффективными электролитами и широко используется в аккумуляторах и батареях.
Кроме того, соли азотной кислоты обладают окислительными свойствами. Они способны передавать кислород или принимать электроны, что делает их важными компонентами в процессах окисления-восстановления. Например, соли азотной кислоты используются в производстве взрывчатых веществ и пиротехники.
Соли азотной кислоты также обладают кислотными свойствами. Они могут отдавать протоны или образовывать комплексы с металлами, что позволяет использовать их в качестве катализаторов в химических реакциях. Кроме того, соли азотной кислоты являются важными компонентами удобрений благодаря своей способности поставлять растениям необходимый азот для их роста и развития.
Таким образом, соли азотной кислоты обладают широким спектром химических свойств, которые делают их полезными в различных областях промышленности.
Состав и структура солей азотной кислоты
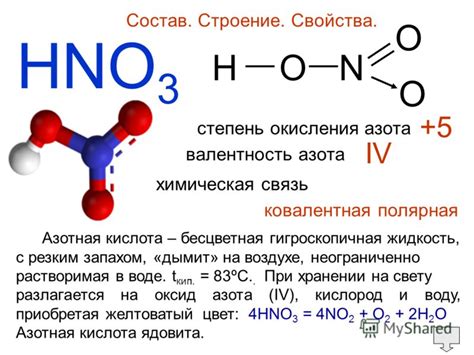
Соли азотной кислоты - это химические соединения, образованные в результате реакции азотной кислоты с металлами или основаниями. В составе солей азотной кислоты присутствует катион металла и анион нитратного иона.
Структура солей азотной кислоты обычно представляет собой кристаллическую решетку, устроенную таким образом, что каждый катион окружен несколькими анионами, а каждый анион взаимодействует с несколькими катионами. Такая структура обеспечивает стабильность и прочность солей.
Соли азотной кислоты по своему составу могут быть однозначные или многозначные. В случае однозначных солей, катион может быть одноатомным (например, натрием или калием), а анион представляет собой нитратный ион. В случае многозначных солей, катион может быть многоатомным, например, алюминием или железом, а анион также представляет собой нитратный ион.
Соли азотной кислоты могут образовывать комплексы с другими соединениями, что делает их особенно интересными для исследования в области химии. Они также широко используются в промышленности в качестве удобрений и взрывчатых веществ.
- Состав и структура солей азотной кислоты определяют их свойства и реактивность.
- Соли азотной кислоты имеют важное значение в химической промышленности и сельском хозяйстве.
- Исследования в области солей азотной кислоты способствуют разработке новых материалов и технологий.
Таким образом, понимание состава и структуры солей азотной кислоты является важным для понимания и изучения их свойств и применения в различных областях науки и промышленности.
Физические свойства солей азотной кислоты

Соли азотной кислоты являются кристаллическими веществами, обладающими определенными физическими свойствами.
Первое физическое свойство — это цвет. Соли азотной кислоты могут быть как бесцветными, так и иметь различные оттенки. Например, нитраты меди имеют синий или зеленый цвет, нитраты свинца — белый, нитраты бария — бесцветные.
Второе свойство — это растворимость в воде. Большинство солей азотной кислоты хорошо растворяется в воде, образуя прозрачные растворы. Однако, некоторые соли, такие как аммонийнитрат или калийнитрат, легко растворяются в воде, при этом происходит поглощение тепла. Это свойство используется при производстве холодных смесей и пиротехнических изделий.
Третье свойство — это температура плавления. Соли азотной кислоты плавятся при определенных температурах в зависимости от их состава. Например, нитрат аммония плавится при температуре около 169 градусов Цельсия, нитрат калия — при 334 градусах Цельсия.
Четвертое физическое свойство — это плотность. Соли азотной кислоты обладают различными плотностями в зависимости от их состава. Значение плотности может варьироваться от 1 г/см³ у нитрата свинца до 2,257 г/см³ у нитрата бария.
Изучение физических свойств солей азотной кислоты позволяет понять и предсказать их способность к растворению, плавлению и другим физическим процессам. Это важно для понимания и применения этих соединений в различных областях науки и промышленности.
Реакции металлов с солями азотной кислоты
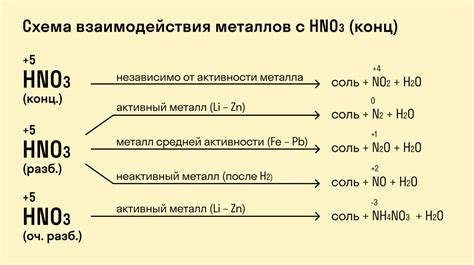
Азотная кислота (HNO3) является сильным окислителем и может реагировать с различными металлами, образуя соли азотной кислоты. Реакции могут протекать с выделением газов, изменением окраски растворов и образованием осадков.
Многие активные металлы, такие как магний (Mg), алюминий (Al), цинк (Zn) и железо (Fe), реагируют с солями азотной кислоты, образуя нитраты металлов и выделяя при этом диоксид азота:
- 2Mg + 2HNO3 → 2Mg(NO3)2 + H2O + NO2
- 2Al + 6HNO3 → 2Al(NO3)3 + 3H2O + 2NO
- Zn + 2HNO3 → Zn(NO3)2 + H2O + 2NO
- 3Fe + 8HNO3 → 3Fe(NO3)3 + 4H2O + 2NO
Активные металлы, вроде натрия (Na) и калия (K), образуют нитраты металлов и аммиак:
- 2Na + 2HNO3 → 2NaNO3 + H2O + NH3
- 2K + 2HNO3 → 2KNO3 + H2O + NH3
Металлы такие, как свинец (Pb), медь (Cu) и серебро (Ag), практически не реагируют с азотной кислотой, особенно в разбавленных растворах.
Реакции металлов с солями азотной кислоты имеют значительное значение в химии и промышленности. Нитраты металлов и аммиак являются важными промышленными продуктами, используемыми в производстве удобрений, взрывчатых веществ и других химических соединений.
Образование оснований при реакции с металлами

Металлы могут реагировать с солями азотной кислоты, образуя основания. Реакция происходит при контакте металла с раствором соли азотной кислоты. При этом происходит окисление металла и восстановление азотной кислоты:
- При реакции металла с нитратом меди образуется основание и образуется оксид азота:
- Реакция железа с нитратом свинца также приводит к образованию основания и оксида азота:
- При реакции алюминия с нитратом кадмия образуется основание и оксид азота:
3Cu + 8HNO3 → 3Cu(NO3)2 + 4H2O + 2NO
3Fe + 8Pb(NO3)2 → 3Fe(NO3)2 + 8Pb + 2NO
2Al + 3Cd(NO3)2 → 2Al(NO3)3 + 3Cd + N2O
Таким образом, взаимодействие металлов с солями азотной кислоты приводит к образованию оснований и освобождению оксидов азота. Эти реакции являются примерами окислительно-восстановительных процессов, в которых металлы выступают в роли восстановителей, а азотная кислота - в роли окислителя.
Вопрос-ответ

Какие металлы реагируют с солями азотной кислоты?
Металлы, такие как магний, цинк, алюминий, медь, свинец и другие, реагируют с солями азотной кислоты.
Как происходит взаимодействие металлов с солями азотной кислоты?
При взаимодействии металлов с солями азотной кислоты происходит реакция окисления металла. В результате этой реакции образуются соответствующие нитраты металлов и выделяется слизистый, коричневато-желтоватый газ оксид азота.
