Металлы и соли являются важными компонентами химической реакции, которые происходят в природных и промышленных процессах. Взаимодействие металлов с солями позволяет получить различные соединения и может привести к различным реакциям в зависимости от условий и типа металла.
Одним из ключевых факторов, влияющих на взаимодействие металлов с солями, является электрохимический потенциал. Металлы с низким электрохимическим потенциалом имеют большую склонность к окислению, тогда как металлы с высоким потенциалом имеют большую склонность к восстановлению. Взаимодействие этих металлов с солями может привести к различным химическим реакциям, таким как образование осадка, выделение газа или изменение цвета раствора.
Особенности взаимодействия металлов с солями также зависят от конкретного типа соли. Например, реакция между металлом и хлоридом может привести к образованию хлорида металла, тогда как реакция с нитратом может привести к окислению металла или образованию других соединений. Также взаимодействие металлов с солями может определяться кислотностью реакции, наличием катализаторов или других добавок.
Влияние солей на металлы

Соли являются химическими соединениями, содержащими ионы металлов и анионы. Взаимодействие солей с металлами может привести к различным реакциям и изменениям в их структуре и свойствах.
Одним из основных эффектов взаимодействия солей с металлами является коррозия. Когда металл контактирует с раствором соли, происходит окисление его поверхности, что приводит к образованию оксидов, гидроксидов или солей металла. При этом поверхность металла может разрушаться и образовываться коррозионная патина.
Некоторые соли могут также влиять на свойства металлов. Например, добавление определенных солей может повысить тугоплавкость или твердость металла. Также соли могут изменить структуру металла и его кристаллическую решетку, что может привести к изменению механических или электрических свойств.
Взаимодействие солей с металлами может также приводить к образованию комплексных соединений. Комплексные соединения — это структурные образования, в которых металл формирует координационные связи с молекулами или ионами других веществ. Образование комплексных соединений может изменить свойства и реактивность металла, а также влиять на его способность к каталитическим реакциям.
Таким образом, взаимодействие солей с металлами может иметь разнообразные эффекты, в том числе как полезные, так и нежелательные, в зависимости от конкретных условий и свойств металла и соли, а также от целей и задач исследования или применения.
Химические реакции

Химическая реакция – это процесс превращения одного или нескольких веществ в другие с образованием новых химических соединений. Взаимодействие металлов с солями приводит к различным химическим реакциям, которые могут происходить с образованием осадков, выделением газов или изменением цвета раствора.
Одной из таких реакций является обменная реакция, при которой ионы одного металла вытесняют ионы другого металла из его соли. Например, при взаимодействии цинка с раствором медного купороса образуется осадок красного металлического меди, а цинк переходит в ионное состояние.
Еще одной химической реакцией, которая может происходить при взаимодействии металлов с солями, является окислительно-восстановительная реакция. Например, при взаимодействии железа с раствором медного купороса, железо переходит в ионное состояние, а медь выпадает в виде осадка. В данной реакции медь действует как окислитель, а железо – как восстановитель.
Изменение цвета раствора также свидетельствует о химической реакции. Например, при взаимодействии марганца с раствором калийной перманганата, раствор приобретает фиолетовый цвет. В данной реакции ионы марганца восстанавливаются и образуют комплексы, что приводит к изменению цвета.
Коррозия металлов

Коррозия – это процесс постепенного разрушения или изменения свойств металлов под воздействием окружающей среды. В основе коррозии лежат химические реакции между металлом и солями, влагой, кислородом или другими химическими веществами.
Один из самых распространенных видов коррозии - ржавчина. Ее провоцирует воздействие влаги и кислорода на поверхность железа или стали. При этом происходит окисление железа и образование гидроксидов и оксидов железа, которые придают поверхности ржавый цвет и делают ее хрупкой.
Для защиты металлов от коррозии используют различные методы. Один из них – гальваническая защита, когда на поверхность металла наносится покрытие из менее реактивного металла. Второй метод – использование антикоррозийных покрытий, например, эмали, лака или специальных красок.
Коррозия может привести к серьезным последствиям, особенно в технических системах и сооружениях. Поэтому очень важно проводить регулярный контроль и предупреждать появление коррозии, например, путем применения антикоррозийных покрытий или системы катодной защиты.
Однако не все металлы одинаково подвержены коррозии. Например, алюминий проявляет хорошую коррозионную стойкость благодаря образованию на поверхности окисной пленки. Нержавеющая сталь также является устойчивой к коррозии благодаря содержанию в составе хрома и никеля.
Окисление и восстановление
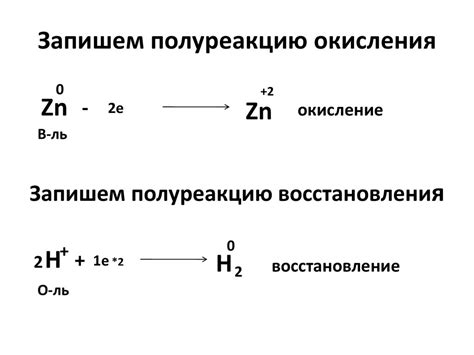
Окисление и восстановление являются важными процессами во взаимодействии металлов с солями. Окисление - это процесс потери электронов, а восстановление - приобретение электронов.
Окисление металлов может происходить под воздействием соляных растворов. В результате окисления, металл образует окислитель, который оставляется в растворе, а сам металл претерпевает потерю электронов. Например, железо взаимодействует с серной кислотой, образуя сульфат железа и выделяя водород.
Восстановление металлов, напротив, происходит за счет приобретения электронов в химической реакции. Оно может происходить при взаимодействии металлов с солями, когда металл принимает электроны от иона металла в растворе. Например, цинк может быть восстановлен из раствора сульфата цинка, когда цинк принимает два электрона и образует металлический цинк.
Окисление и восстановление металлов с солями являются основой таких важных процессов, как гальваническая коррозия и электрохимическая реакция в батареях. Понимание этих процессов позволяет эффективно использовать металлы и их соединения для различных технических и промышленных целей.
Термические реакции

Термические реакции – это реакции, которые происходят при повышенных температурах. В основе этих реакций лежит тепловое воздействие на вещество, что приводит к изменению его свойств и образованию новых соединений.
Одним из примеров термических реакций является термическое разложение соединений. При нагревании некоторых соединений, например, карбонатов металлов, происходит их разложение на оксиды и выделение углекислого газа. Эта реакция происходит при высоких температурах и используется, например, при производстве цемента.
Другим примером термической реакции является термическое восстановление металлов из их оксидов. При нагревании оксида металла с углеродом или водородом происходит реакция, в результате которой металл восстанавливается из оксида. Например, таким образом получают алюминий из его оксида алюминия, а также железо, медь и другие металлы.
Термические реакции являются важным инструментом в химической промышленности, так как позволяют получать различные соединения и материалы. Они также используются в лабораторных исследованиях для изучения свойств веществ и получения новых соединений.
Образование сплавов

Образование сплавов - это процесс соединения двух или более различных металлов, в результате которого образуется новый материал с улучшенными или измененными свойствами. Сплавы имеют широкое применение в различных отраслях промышленности, включая производство автомобилей, строительства, электроники и т.д.
При образовании сплавов происходит смешивание расплавленных металлов или твердых частиц, после чего происходит реорганизация и взаимодействие атомов двух или более металлов. В результате этого процесса образуется новая кристаллическая структура со своими характерными свойствами.
Образование сплавов может происходить путем физического или химического взаимодействия металлов. Физическое взаимодействие основано на смешении расплавленных металлов при высокой температуре, в то время как химическое взаимодействие происходит при реакции металлов с различными химическими соединениями.
Сплавы обладают улучшенными механическими, электрическими и химическими свойствами по сравнению с исходными металлами. Они могут быть более прочными, устойчивыми к коррозии, иметь более низкую плотность или быть легкообрабатываемыми. Кроме того, сплавы могут иметь специальные свойства, такие как электрическая проводимость или магнитные свойства, что делает их полезными в различных областях науки и техники.
Электрохимические реакции

Электрохимические реакции являются основой для понимания взаимодействия металлов с солями. Они происходят при передаче электронов между различными химическими веществами. Процессы окисления и восстановления играют ключевую роль в электрохимических реакциях. Когда металлы вступают в контакт с растворами солей, происходит передача электронов, что приводит к изменению степени окисления металла и образованию новых соединений.
При электрохимических реакциях можно выделить два основных процесса - окисление и восстановление. Окисление - это процесс, при котором металл отдает электроны. Восстановление - наоборот, процесс, при котором металл принимает электроны. Взаимодействие металлов с солями обычно сопровождается одновременным окислением металла и восстановлением ионов металла из соли.
Процессы окисления и восстановления при электрохимических реакциях можно представить в виде кислородного ряда. В этом ряду металлы располагаются в порядке возрастания их способности окисляться. Металлы, находящиеся выше в кислородном ряду, обладают большей активностью и легче окисляются. При взаимодействии с солями, активные металлы окисляются, а менее активные металлы восстанавливаются.
Электрохимические реакции, такие как окисление металлов и образование соединений солями, находят широкое применение в различных областях, включая электрохимию, гальванические элементы, электролиз, и многое другое. Понимание этих реакций позволяет улучшить производственные процессы и разработать новые технологии.
Применение в промышленности

Взаимодействие металлов с солями имеет широкое применение в различных отраслях промышленности. Одним из основных направлений является металлургия. Металлы, такие как железо, алюминий, цинк и медь, используются для производства различных конструкционных материалов и металлических изделий.
Например, в процессе гальванического покрытия металлов на поверхность других материалов, происходит взаимодействие металла с солями. Этот процесс используется в производстве электроники, автомобильной промышленности и других отраслях, где требуется защита поверхности от коррозии и создание декоративных покрытий.
Одним из важных применений взаимодействия металлов с солями является получение специальных сплавов и композитных материалов. Например, добавление определенного металла в сплав может повысить его прочность или стойкость к коррозии. С помощью таких сплавов изготавливаются детали авиационной техники, машин строительной промышленности и других изделий, где требуются особые свойства материала.
Кроме того, взаимодействие металлов с солями используется в обработке поверхности различных материалов. Например, при анодной окислительной обработке алюминия происходит взаимодействие металла с раствором солей. Этот процесс позволяет получить защитные и декоративные покрытия на поверхности алюминиевых изделий.
Вопрос-ответ

Какие металлы взаимодействуют с солями?
Различные металлы могут взаимодействовать с солями, включая алюминий, медь, железо, никель и цинк.
Какие реакции могут происходить при взаимодействии металлов с солями?
При взаимодействии металлов с солями могут возникать разные реакции, включая образование осадка, выделение газа или изменение цвета раствора.
Какие металлы реагируют с солями с наибольшей интенсивностью?
Некоторые металлы, такие как натрий и калий, обладают высокой активностью и могут реагировать с солями с большой интенсивностью.
Какие факторы могут влиять на скорость реакции металлов с солями?
Скорость реакции между металлами и солями может зависеть от различных факторов, таких как температура, концентрация раствора и тип металла.
