Взаимодействие концентрированной серной кислоты с металлами является одним из важных процессов в химии. Происходит оно в результате реакции металла с серной кислотой, в результате которой выделяется водород.
Водород, выделяющийся при взаимодействии металла с концентрированной серной кислотой, является одним из самых популярных веществ в химических процессах. Он широко применяется в различных отраслях промышленности, таких как производство аммиака, обогащение масел и жиров, а также в процессах образования цветных металлов и покрытий.
Реакция взаимодействия металла с серной кислотой происходит в несколько стадий. Сначала металл реагирует с серной кислотой, образуя сульфат металла и водород. Затем водород освобождается в виде газа и может быть собран для дальнейшего использования или утилизации.
Важно отметить, что процесс выделения водорода из серной кислоты может быть опасным, так как при неправильном обращении с кислотой могут возникнуть взрывоопасные ситуации. Поэтому необходимо соблюдать все предосторожности и правила безопасности при работе с концентрированной серной кислотой.
Взаимодействие концентрированной серной кислоты с металлами и выделение водорода является важным процессом в химии, который находит широкое применение в различных отраслях промышленности. Однако необходимо помнить о возможных опасностях и соблюдать меры предосторожности при работе с серной кислотой.
Взаимодействие концентрированной серной кислоты с металлами
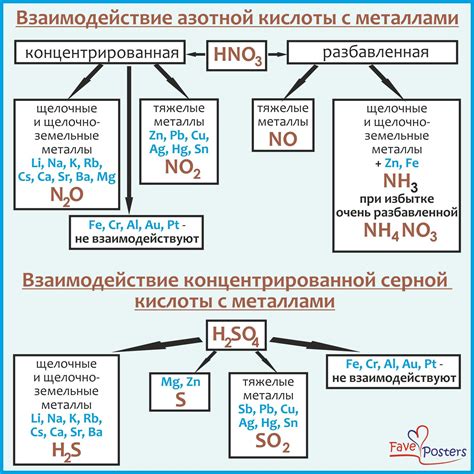
Взаимодействие концентрированной серной кислоты с металлами является одной из важных реакций в химии. При этом происходит образование солей и выделение водорода газа.
Концентрированная серная кислота, химическая формула которой H2SO4, действует на металлы, причиняя им значительный химический разложение. В результате такой реакции металлы окисляются, а серная кислота восстанавливается.
В процессе взаимодействия выделяется водород газ, который можно обнаружить, проведя пробную палочку надо концентрированной серной кислотой. Когда палочка зажжется, это будет доказательством выделения водорода. Возможно также и использование небольшой металлической пластинки, которая будет покрываться пузырьками водорода.
Реакция между концентрированной серной кислотой и металлами является экзотермической, то есть выделяется большое количество теплоты. Поэтому при проведении данной реакции необходимо быть предельно осторожным, так как она сопровождается выделением паров серной кислоты и сильно разогреется.
Реакция серной кислоты с металлами

Серная кислота (H2SO4) является одной из самых сильных кислот, которая способна взаимодействовать с различными металлами и образовывать с ними соответствующие соли.
Реакция серной кислоты с металлами происходит с образованием соли и выделением водорода. В результате взаимодействия серной кислоты с металлом молекулы кислоты отнимают электроны у металла, превращаясь в ионы серы, а металл в свою очередь отдает электроны, что приводит к выделению молекулярного водорода.
Реакция серной кислоты с металлами происходит по следующему уравнению:
H2SO4 + M → MSO4 + H2,
где M - металл, а MSO4 - соль серной кислоты с данным металлом.
Реактивность серной кислоты с металлами зависит от различных факторов, таких как концентрация кислоты, температура, свойства самого металла и так далее. Некоторые металлы, такие как цинк (Zn) и железо (Fe), быстро реагируют с серной кислотой, образуя соответствующие соли и выделяя большое количество водорода. В то же время, некоторые металлы, такие как медь (Cu) и серебро (Ag), медленно реагируют с серной кислотой или вовсе не реагируют, так как они обладают большей устойчивостью к окислению.
Химический состав и свойства серной кислоты
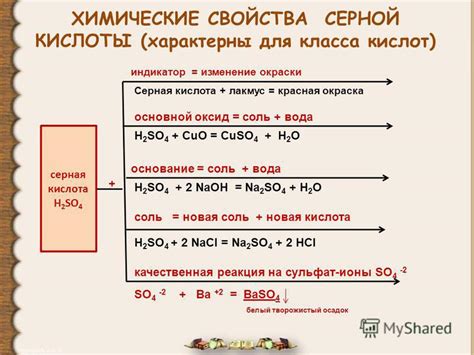
Серная кислота (H2SO4) – это одна из самых распространенных и важных кислот в химии. Она состоит из двух атомов водорода (H), одного атома серы (S) и четырех атомов кислорода (O). Кислота обладает мощными окислительными свойствами и широко применяется в различных отраслях науки и промышленности.
Свойства серной кислоты обусловлены ее химическим составом. Она является безцветной, вязкой жидкостью с характерным запахом. Серная кислота обладает сильной кислотностью, что проявляется в ее способности образовывать ион H3O+ (гидрония) в водном растворе. Эта кислотность делает серную кислоту опасным и коррозионноактивным веществом.
Серная кислота является сильным дегидратирующим агентом, способствуя образованию воды при взаимодействии с многими веществами. Она также обладает окислительными свойствами, способствуя окислению других веществ, например, металлов, водорода и неорганических соединений.
Серная кислота является реагентом множества химических реакций. Она может действовать как кислота, растворяя многие металлы, освобождая водород и образуя соответствующие соли. Это свойство широко используется в промышленности, например, при получении водорода, очистке металлов и производстве удобрений.
Некоторые характеристики серной кислоты:
- Молекулярная масса: 98 г/моль;
- Плотность: 1,84 г/см³;
- Температура кипения: 337 °C;
- Растворимость: хорошо растворяется в воде;
- Формула: H2SO4;
- Стандартная энтальпия образования: -814,5 кДж/моль.
Серная кислота является важным реагентом и ингредиентом во многих процессах и синтезах, которые она делает возможными благодаря своим физическим и химическим свойствам.
Классификация металлов по их способности взаимодействовать с серной кислотой
Металлы различаются по своей способности взаимодействовать с серной кислотой. Это обусловлено их химическими свойствами и электрохимическим потенциалом. В результате взаимодействия металлов с серной кислотой возникают реакции, в результате которых образуется водород.
Способность металла взаимодействовать с серной кислотой можно классифицировать на три уровня: активные, умеренные и пассивные металлы.
Активные металлы, такие как натрий, калий и литий, обладают высокой способностью взаимодействовать с серной кислотой. При контакте с серной кислотой активные металлы быстро реагируют, выделяя значительное количество водорода.
Умеренные металлы, такие как железо, медь и алюминий, имеют среднюю способность взаимодействовать с серной кислотой. Реакция умеренных металлов с серной кислотой протекает медленнее, чем у активных металлов, и выделение водорода происходит в меньших количествах.
Пассивные металлы, такие как золото, серебро и платина, имеют низкую способность взаимодействовать с серной кислотой. Реакция пассивных металлов с серной кислотой практически не протекает, и выделение водорода при их взаимодействии незначительно.
Такая классификация металлов позволяет оценить их активность в химических реакциях с серной кислотой и определить возможность выделения водорода при их взаимодействии.
Механизм реакции выделения водорода
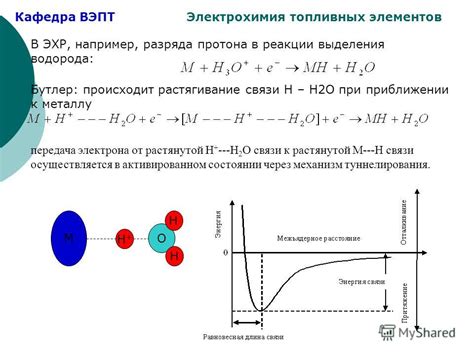
Выделение водорода при взаимодействии концентрированной серной кислоты с металлами осуществляется по следующему механизму.
- Серная кислота (H2SO4) вводится в реакционную смесь и происходит ее ионизация, образуя ионы H+ и SO42-.
- Металлический элемент включается в реакцию с серной кислотой, отдавая электроны и образуя положительные ионы металла.
- Ионы водорода (H+) реагируют с электронами, образованными в результате окислительного взаимодействия металла с кислотой.
- Ионы водорода (H+) соединяются между собой и образуют молекулы водорода (H2).
Таким образом, реакция выделения водорода при взаимодействии концентрированной серной кислоты с металлами происходит благодаря ионизации кислоты и образованию положительных и отрицательных ионов. Ионы водорода реагируют с образовавшимися электронами, образуя молекулы водорода. Это является одной из методик получения чистого водорода в лабораторных условиях.
Практическое применение реакции выделения водорода

Реакция выделения водорода, при которой серная кислота взаимодействует с металлом, обладает широким практическим применением в различных отраслях науки и промышленности.
В биологии и медицине реакция выделения водорода используется для получения чистого водорода, который может быть использован в качестве энергетического источника при проведении различных экспериментов и исследований. Также водород, образующийся в результате реакции с серной кислотой, может быть использован в процессе синтеза различных медицинских препаратов.
В химической промышленности реакция выделения водорода находит свое применение при производстве взрывчатых веществ и синтезе различных соединений. Водород, полученный из серной кислоты, может быть использован в качестве реактивного газа при проведении различных химических реакций.
В энергетике реакция выделения водорода играет важную роль. Полученный водород может быть использован в рамках технологии водородного сжигания, которая позволяет получать электроэнергию без выброса вредных веществ в атмосферу. Также водород, полученный из серной кислоты, может служить топливом для водородных топливных элементов, которые могут использоваться в различных устройствах и механизмах.
Таким образом, реакция выделения водорода является важным процессом, который находит применение в различных сферах науки и промышленности. Ее использование позволяет получать чистый водород, который может быть использован в различных технологических процессах и устройствах, в том числе в биологии, медицине, химической промышленности и энергетике.
Безопасность и меры предосторожности при работе с концентрированной серной кислотой

Работа с концентрированной серной кислотой требует особого внимания и соблюдения мер безопасности. Серная кислота является сильным коррозионным агентом, обладает ядовитыми свойствами и может вызвать ожоги на коже и глазах.
Перед началом работы с серной кислотой необходимо принять ряд мер предосторожности, чтобы обеспечить безопасность и предотвратить возможные несчастные случаи.
- Наденьте лабораторные перчатки, защитные очки и халат, чтобы защитить кожу и глаза от попадания серной кислоты.
- Работайте в хорошо проветриваемой области или под вытяжкой, чтобы избежать ингаляции паров серной кислоты, которые могут вызвать ожоги дыхательных путей.
- Избегайте соприкосновения серной кислоты с органическими веществами, так как это может привести к возникновению воспламенения или взрыву.
- Храните серную кислоту в специальных прочных контейнерах, которые устойчивы к ее действию и предотвращают утечку или разливание.
- При разливании или случайном контакте с серной кислотой, незамедлительно промойте затронутую область большим количеством воды и обратитесь к медицинскому специалисту.
Профессиональная работа с концентрированной серной кислотой требует специальных навыков и знаний, поэтому перед ее использованием следует пройти соответствующую подготовку и получить соответствующую инструкцию от опытного специалиста.
Вопрос-ответ

Какие металлы реагируют с концентрированной серной кислотой?
С концентрированной серной кислотой реагируют многие металлы, включая железо, цинк, алюминий, магний и многие другие. Реакция происходит под образованием водорода и соответствующих солей кислоты.
Каков механизм реакции металлов с концентрированной серной кислотой?
Механизм реакции металлов с концентрированной серной кислотой основан на окислительно-восстановительной реакции. Водород, который образуется в результате взаимодействия металлов с кислотой, является восстановителем, а металлы участвуют в окислительной части реакции. Кислота окисляет металлы, а металлы восстанавливают кислоту, образуя соли.
Какова роль концентрации серной кислоты в реакции с металлом?
Концентрация серной кислоты влияет на скорость реакции с металлом. При более высокой концентрации серной кислоты реакция может проходить более интенсивно и быстро, так как концентрированная кислота содержит большее количество ионов водорода, которые могут вступать в реакцию с металлом.
Какова важность выделения водорода при реакции металлов с концентрированной серной кислотой?
Выделение водорода является одним из основных результатов реакции металлов с концентрированной серной кислотой. Это явление позволяет идентифицировать реакцию между кислотой и металлом и дает возможность использовать выделенный водород, например, в качестве горючего или для других химических реакций.
