В технике и научных исследованиях, использование различных веществ для растворения металлов играет важную роль в различных процессах и экспериментах. Существует несколько веществ, которые способны растворять металлы, и каждое из них обладает своими уникальными свойствами и химической реактивностью.
Одним из самых популярных веществ для растворения металлов является кислота. Сильные кислоты, такие как серная кислота и соляная кислота, обладают способностью агрессивно взаимодействовать с металлическими ионами, вызывая их растворение в воде или других растворителях. Это происходит за счет образования ионов металла и ионов водорода в реакции кислоты с металлом. Однако, растворение металла в кислоте может быть опасным процессом, требующим особой осторожности и знания о свойствах используемой кислоты и металла.
Кроме кислот, стихийное растворение металлов может быть достигнуто с помощью щелочных растворителей, таких как гидроксид натрия или гидроксид калия. Эти вещества обладают сильно щелочным характером и могут растворять различные металлы, образуя ионные соединения. Реакции растворения металлов в щелочных растворителях могут происходить с выделением водорода и образованием гидроксидных ионов металла.
Кислоты и основания

Кислоты – это химические вещества, обладающие кислотными свойствами. Они могут растворять металлы, образуя с ними соли. Некоторые известные кислоты, способные растворять металлы, включают соляную кислоту, азотную кислоту и серную кислоту. Способность кислот к растворению металлов определяется их химическим составом и концентрацией.
Основания – это химические соединения, обладающие щелочными свойствами. Они также могут растворять металлы, образуя с ними соли. Примерами оснований, способных растворять металлы, являются гидроксиды, такие как натриевый гидроксид (щелочь) и калиевый гидроксид (поташ). Основания могут реагировать с металлами, образуя гидроксиды металлов и выделяя водород.
Кислоты и основания различаются по своей химической природе и энергии реакции с металлами. Некоторые кислоты, такие как соляная кислота, могут растворять металлы, такие как железо и алюминий, даже при низких концентрациях и без нагревания. Основания же обычно более активны в растворении металлов, особенно если они сильные щелочи, такие как калиевый гидроксид.
Комплексообразующие вещества

Комплексообразующие вещества - это группа химических соединений, способных образовывать стабильные комплексы с металлическими ионами. Они играют важную роль в процессах растворения металлов и используются в различных областях, включая промышленность и научные исследования.
Комплексообразующие вещества обладают способностью образовывать координационные соединения с металлическими ионами, при которых центральный металлический ион окружается лигандами. Лиганды могут быть анионы, нейтральными молекулами или их комбинацией. Образование комплекса может происходить в результате обменных реакций или хелатирования.
Комплексы, образующиеся с помощью комплексообразующих веществ, обладают различными свойствами и могут быть стабильными либо легко разлагаться. Стабильные комплексы обычно образуются с металлами, имеющими большую электроотрицательность, что позволяет образовать сильные связи с лигандами. Легко разлагаемые комплексы обычно образуются с металлами, имеющими малую электроотрицательность, что делает их менее стабильными.
Комплексообразующие вещества играют важную роль в различных приложениях. В промышленности они используются для растворения и извлечения металлов из руд и отходов. В научных исследованиях они применяются для синтеза и изучения новых комплексов и координационных соединений. Кроме того, комплексообразующие вещества широко применяются в аналитической химии для определения и разделения металлических ионов.
Соли

Соли - это растворы, которые содержат положительные и отрицательные ионы. В химии существует огромное количество различных солей, и многие из них способны растворять металлы.
Соли, образованные от щелочей и кислот, могут образовывать комплексные соединения с металлами, что способствует их растворению. К примеру, соль серной кислоты (H2SO4) - серная соль, служит растворителем для многих металлов, включая железо, медь и алюминий.
Некоторые соли, такие как хлорид железа или нитрат меди, могут растворять металлы путем окисления. Окисление - это процесс передачи электронов, и когда металл окисляется, он может растворяться во взаимодействующем растворе солью.
Соли могут также образовывать комплексы с металлами и тем самым снижать их степень ионизации, что делает их более растворимыми в воде. Это особенно верно для солей, содержащих аммонийные ионы, которые образуют стабильные комплексы с многими металлами.
В заключение, соли являются мощными растворителями металлов, благодаря своему составу и способности образовывать комплексы с металлическими ионами. Это делает их важными компонентами в различных процессах и химических реакциях, которые включают в себя металлы.
Расплавы

Расплавы - это вещества, обладающие способностью растворять металлы. Они широко применяются в различных отраслях промышленности, таких как металлургия, химическая промышленность и электротехника.
Расплавы являются основным составным элементом в процессе плавления и обработки металлов. Они обладают высокой температурой плавления, что позволяет использовать их для плавки различных металлических сплавов.
Одним из наиболее распространенных расплавов является алюминиевый расплав, который применяется в алюминиевой промышленности. Алюминиевый расплав обладает высокой электропроводностью и хорошей теплопроводностью, что делает его идеальным материалом для производства проводов и различных электронных устройств.
Важно отметить, что не все металлы могут быть растворены в расплавах. Некоторые металлы, такие как золото и платина, обладают высокой устойчивостью к растворению и требуют применения более агрессивных химических реагентов.
Кроме того, расплавы часто используются в процессе литья металлов. Они позволяют получить изделия с высокой точностью и качеством, что особенно важно в автомобильной и машиностроительной промышленности.
В целом, использование расплавов является неотъемлемой частью современного производства металлических изделий. Они обладают рядом полезных свойств, которые позволяют решать широкий спектр задач и обеспечивать высокую эффективность процессов обработки металлов.
Вода и влажность

Вода и влажность играют важную роль в растворении металлов. Универсальность воды как растворителя объясняется ее способностью образовывать воду координированные соединения с металлами. Вода является полюсным растворителем, что позволяет ей эффективно взаимодействовать с металлами, образуя гидроксиды, оксиды или соли.
Влажность играет важную роль в растворении металлов, так как высокая влажность воздуха может приводить к образованию водных растворов оксидов металлов на поверхности металлических предметов. Это происходит благодаря реакции металла с водой и кислородом воздуха.
Вода, содержащая различные растворенные вещества, может также растворять металлы. Например, кислотная вода может растворять металлы, такие как железо или алюминий. Это происходит из-за того, что кислота реагирует с металлом, образуя соль и выделяя водород.
Помимо этого, растворение металлов может происходить в ряде других жидкостей, таких как растворы солей или кислот. Некоторые органические растворители, такие как этиленгликоль или изопропанол, также могут растворять определенные металлы.
Реактивы

Реактивы - это химические вещества, которые используются для проведения химических реакций и определения наличия или количества определенных веществ. В контексте растворения металлов, реактивы играют важную роль.
Одним из наиболее широко используемых реактивов является кислота. Кислоты, такие как серная кислота, соляная кислота и азотная кислота, могут растворять различные металлы. Например, серная кислота может растворить металлы, такие как железо, цинк и медь. Соляная кислота применяется для растворения металлов, таких как свинец и серебро. Азотная кислота, в свою очередь, может растворить свинец и медь.
Однако, не только кислоты могут быть использованы для растворения металлов. Щелочи, такие как натриевая гидроксид или калиевая гидроксид, также способны растворять металлы. Они образуют с металлами основания, что приводит к их растворению. Например, натриевая гидроксид может растворить алюминий и цинк, а калиевая гидроксид - алюминий и железо.
Также существуют другие реактивы, которые могут растворять металлы. Например, галогены, такие как йод, хлор или бром, также способны взаимодействовать с некоторыми металлами и образовывать вещества, растворимые в воде. Также некоторые комплексообразующие вещества, такие как эдтазная кислота или аммиак, могут растворять определенные металлы.
Органические растворители

Органические растворители – это вещества, состоящие из органических соединений, способные растворять металлы. Их использование широко распространено в различных отраслях промышленности, научных исследований и быта.
Органические растворители обладают высокой растворительной способностью и хорошей растворимостью металлов, что делает их отличным средством для очистки и обработки металлических поверхностей. Они позволяют удалить окислы, загрязнения и защитные покрытия с поверхности металла, предварительно подготавливая его к дальнейшей обработке или нанесению нового покрытия.
Список органических растворителей, используемых для растворения металлов, включает в себя различные спирты, ацетон, эфиры, алканы и др. Каждый из них обладает своими особенностями и применяется в зависимости от конкретной задачи. Например, этиловый спирт широко применяется в лабораторных условиях для растворения металлов и получения растворов для дальнейших исследований.
Органические растворители не только растворяют металлы, но и способствуют активации химических реакций, увеличивая скорость их протекания. Они также могут использоваться в процессе синтеза новых соединений, так как способствуют повышению селективности и выхода конечного продукта.
Однако необходимо помнить, что органические растворители могут быть токсичными и вызывать негативное воздействие на организм. При использовании таких веществ необходимо строго соблюдать меры безопасности, работать в хорошо проветриваемом помещении и использовать защитные средства.
Электролиты
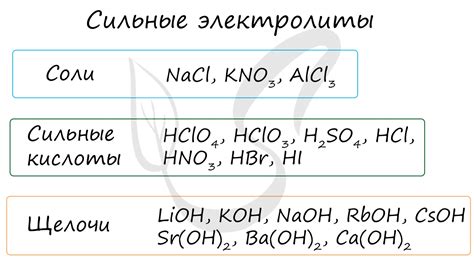
Электролитами называют вещества, способные протекать электрический ток в растворе. Они играют важную роль в растворении металлов.
В электролитах металлы растворяются благодаря ионному обмену между ионами металла и ионов растворителя. При погружении металлического предмета в электролит, он начинает давать ионы металла, которые переходят в состав раствора. Это происходит благодаря наличию свободных электродов в растворе, на которых ионы металла оседают в виде металлического отложения.
Наиболее распространенными электролитами, способными растворять металлы, являются кислотные и щелочные растворы. Кислоты содержат ионы водорода (H+) и отрицательные радикалы, которые реагируют с ионами металла, образуя соль и выделяя газ. Щелочи, напротив, содержат ионы гидроксида (OH-) и положительные радикалы. Они также способны растворять металлы путем образования солей и выделения водорода.
Кроме того, некторые соли также могут действовать как электролиты и растворять металлы. Например, хлориды и нитраты некоторых металлов (например, натрия, калия или аммиака) обладают достаточной растворимостью, чтобы действовать как электролиты и растворять металлы.
Кроме того, специальные электролиты могут быть созданы для специфического растворения металлов. Например, некоторые металлы могут быть растворены в электролите, состоящем только из ионов металла, без образования соли или газа.
Вопрос-ответ

Какие вещества могут растворить металлы?
Многие кислоты, такие как серная кислота (H2SO4), соляная кислота (HCl) и азотная кислота (HNO3), способны растворять многие металлы. Некоторые другие вещества, такие как хлориды, фториды и натриевые соединения, также могут растворять определенные металлы. Некоторые растворители, такие как аммиак, также могут растворять некоторые металлы.
Какие кислоты могут растворять металлы?
Многие кислоты могут растворять металлы. Например, серная кислота (H2SO4) может растворять в себе множество металлов, включая железо (Fe), медь (Cu) и цинк (Zn). Соляная кислота (HCl) также способна растворять многие металлы, включая магний (Mg) и алюминий (Al). Азотная кислота (HNO3) может растворять металлы, такие как серебро (Ag) и свинец (Pb).
Какие другие вещества могут растворять металлы помимо кислот?
Помимо кислот, некоторые соли и натриевые соединения могут растворять определенные металлы. Например, хлориды и фториды могут растворять некоторые металлы, такие как железо (Fe) и алюминий (Al). Некоторые растворители, такие как аммиак (NH3), могут растворять некоторые металлы, такие как медь (Cu) и серебро (Ag).
Какие металлы могут быть растворены кислотами?
Многие металлы могут быть растворены кислотами. Например, железо (Fe), медь (Cu), цинк (Zn), свинец (Pb) и никель (Ni) могут быть растворены серной кислотой (H2SO4). Магний (Mg) и алюминий (Al) могут быть растворены соляной кислотой (HCl). Серебро (Ag) и свинец (Pb) могут быть растворены азотной кислотой (HNO3).
