Металлы и их соединения играют важную роль в многих химических процессах, в том числе и взаимодействии с растворами солей. В этой статье представлена таблица, которая показывает, какие металлы реагируют с определенными солями и какие продукты образуются в результате данной реакции.
Когда металл вступает в реакцию с раствором соли, происходит обмен ионами. Некоторые металлы имеют большую склонность к реакциям, чем другие, и образуют более стабильные соединения. В таблице представлены наиболее распространенные металлы и соли, с которыми они могут взаимодействовать. В ней также указаны продукты реакции и их химические формулы.
Примеры реакций, представленные в таблице, помогут лучше понять взаимодействие металлов с растворами солей. Например, металл алюминий реагирует с хлоридом натрия, образуя хлорид алюминия и освобождая метан. Эта реакция может быть безопасно проведена в лабораторных условиях под наблюдением специалиста.
Изучение взаимодействия металлов с растворами солей является важной частью химических исследований и имеет практическое применение. Эти реакции могут быть использованы, например, в процессе получения различных металлических соединений или при очистке растворов от примесей.
Таблица, представленная в этой статье, может служить хорошим ориентиром во время проведения экспериментов или для обучения студентов основам химии. Однако, перед проведением любой химической реакции необходимо обратиться к источникам, чтобы убедиться в безопасности и правильном выполнении данного эксперимента.
Металлы в растворах солей

Металлы - это класс химических элементов, которые обладают высокой электропроводностью и свойством отдавать электроны. Взаимодействие металлов с растворами солей является одной из важнейших тем в химии.
Металлические элементы могут образовывать различные соединения с солями. Растворы солей содержат положительно заряженные ионы металлов, которые образуются в результате диссоциации солей в воде. При взаимодействии металлов с растворами солей происходят различные реакции, в результате которых могут образовываться осадки, растворы или газы.
Взаимодействие металлов с растворами солей имеет большую практическую значимость. Например, в гальванических элементах и аккумуляторах используется принцип электролиза - процесс, который основан на взаимодействии металлов с растворами солей. Кроме того, это взаимодействие позволяет производить очистку и получение металлов, а также использовать их в различных технологических процессах.
В таблице представлены некоторые металлы и их реакция с растворами солей. Некоторые металлы реагируют с растворами солей быстро и интенсивно, образуя осадки или выделяя газы. Другие металлы могут быть устойчивыми к реакциям с солями и оставаться в растворе в виде ионов. Изучение взаимодействия металлов с растворами солей помогает понять и предсказать результаты химических реакций и разработать новые материалы и технологии.
Физические свойства металлов
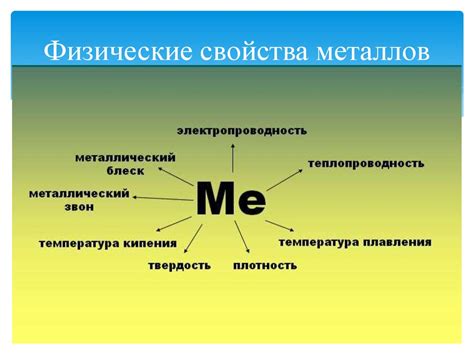
Металлы являются основным классом веществ, обладающих определенными физическими свойствами. Они обладают высокой теплопроводностью, что означает, что они способны передавать тепло эффективно. Это свойство делает их широко используемыми в различных отраслях промышленности, таких как энергетика и машиностроение.
Еще одной характеристикой металлов является их высокая электропроводность. Это позволяет им быть полезными в производстве электрических проводов и компонентов, таких как конденсаторы и контакты. Металлы также обладают высокой плотностью и жидкостью. Это делает их прочными и устойчивыми к внешним воздействиям, таким как удары и давление.
Одним из самых важных физических свойств металлов является их способность быть подверженными пластической деформации. Это означает, что они могут быть легко изгибаемыми, ковкими и прессованными в различные формы без потери своих характерных свойств. Это свойство делает их идеальными для производства различных изделий, включая строительные материалы и различные предметы быта.
Металлы также обладают хорошей устойчивостью к коррозии. Они образуют на поверхности оксидные пленки, которые защищают их от окружающей среды. Однако некоторые металлы, такие как железо, подвержены коррозии и требуют защиты покрытием или специальной обработкой для предотвращения ржавчины.
Все эти физические свойства делают металлы неотъемлемым компонентом нашей повседневной жизни и важными материалами в различных отраслях промышленности.
Химические свойства металлов

Металлы – это элементы, которые обладают определенными химическими свойствами, отличающими их от остальных элементов. Важнейшей химической особенностью металлов является их способность образовывать ионы, имеющие положительный электрический заряд, в ходе химических реакций. Эта способность объяснима наличием свободных электронов, которые могут легко передаваться между атомами металла.
Одной из основных характеристик металлов является их высокая проводимость электричества. Это объясняется тем, что свободные электроны в металле могут свободно двигаться по его структуре и образовывать электрический ток. Большинство металлов также обладают хорошей теплопроводностью, что делает их полезными для создания теплопроводящих материалов.
Металлы обладают также высокой химической активностью. Они могут реагировать с различными веществами, образуя с ними соединения. Например, металлы легко реагируют с кислородом, образуя оксиды металлов. Оксиды металлов в свою очередь могут растворяться в воде, образуя гидроксиды, которые представляют собой основания.
Многие металлы могут также соединяться с неметаллами, образуя сложные химические соединения – соли. Этим объясняется их реакция с растворами солей, при которой происходит образование осадков или раскрашивание раствора.
Взаимодействие металлов с солями

Взаимодействие металлов с растворами солей является основной реакцией, которая может привести к образованию новых соединений и изменению физических свойств их исходных компонентов.
Металлы, как правило, имеют положительный заряд и способны образовывать ионы в растворах. Когда металл погружается в раствор соли, происходит обратная реакция, в результате которой металлные ионы образуются из ионов соли. Это происходит за счет химической реакции между металлом и ионами соли.
Взаимодействие металлов с солями может протекать различными способами, в зависимости от типа металла и соли. Некоторые металлы, например, реагируют с солями, образуя осадок в виде металлического осаждения. Другие металлы могут образовывать растворимые комплексы с солями, что приводит к изменению цвета раствора.
Взаимодействие металлов с солями имеет большое значение в химической промышленности, так как их свойства и возможности бывают разнообразными. Это обусловлено взаимодействием металлов с растворами солей и возможностью образования новых соединений, которые могут использоваться в различных отраслях промышленности.
Окисление и восстановление металлов
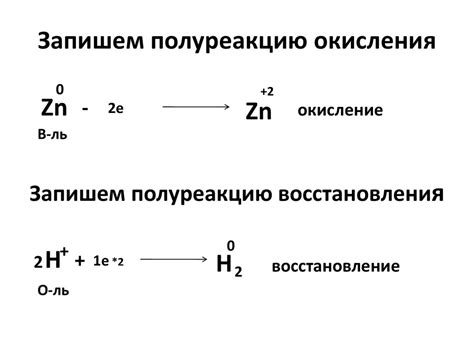
Окисление и восстановление металлов - это важные химические процессы, которые происходят при взаимодействии металлов с растворами солей. Окисление - это процесс, при котором металл отдает электроны, а восстановление - процесс обратный, при котором металл получает электроны.
Металлы могут окисляться различными способами. Один из самых распространенных способов - реакция металла с кислотой. При этом металл отдает электроны, образуется ион металла в растворе, а водородное ионы из кислоты принимают эти электроны, образуя молекулы воды. Примером такой реакции может быть взаимодействие цинка с соляной кислотой:
Zn + 2HCl → ZnCl2 + H2
Также, металлы могут окисляться при взаимодействии с кислородом воздуха. Например, железо под воздействием влажного кислорода окисляется и образует ржавчину. В этом случае, металл отдает электроны кислороду, который присутствует в воздухе, образуя оксид металла.
Восстановление металлов происходит в обратном процессе. Металл принимает электроны от окислителя и образует ион металла или металлический осадок. Например, медь может восстановиться из раствора и образовать медный осадок при взаимодействии с железом:
Cu2+ + Fe → Cu + Fe2+
Окисление и восстановление металлов являются важными химическими процессами, которые находят широкое применение в различных областях, включая производство металлов, электрохимию, аналитическую химию и другие.
Свойства солей металлов

Соли металлов – это химические соединения, которые образуются при реакции металлов с кислотами. Они обладают рядом характерных свойств, которые определяют их широкое использование в различных областях.
Одно из основных свойств солей металлов – это проводимость электричества. Это связано с наличием свободных ионов, которые способны перемещаться в растворе. Именно благодаря этому свойству соли металлов широко используются в электролитах и в процессах электрохимии.
Кроме того, соли металлов обладают кристаллической структурой. Их молекулы образуют регулярную решетку, что придает им прочность и устойчивость. Благодаря этому свойству соли металлов могут быть использованы в производстве керамики, стекла и других материалов.
Растворимость солей металлов – это еще одно важное их свойство. Некоторые соли металлов легко растворяются в воде, образуя прозрачные растворы, а другие – практически нерастворимы. Это свойство позволяет использовать соли металлов в различных процессах химической аналитики и экстракции.
Соли металлов обладают также специфическими свойствами, которые зависят от химического состава и типа металла. Например, некоторые металлы придают солям особый цвет, что используется в качестве индикаторов. Кроме того, некоторые соли металлов обладают светофосфорными свойствами, что позволяет использовать их в производстве светодиодов и флуоресцентных красителей.
Таблица взаимодействия металлов с растворами солей

Взаимодействие металлов с растворами солей является основой для изучения химических реакций и определения активности различных элементов. Проведенные исследования позволяют понять, какие металлы реагируют с определенными солями и в какой степени.
В таблице представлены основные металлы и их реакции с различными солями. Каждый металл имеет свою степень активности, которая определяется его электрохимическим потенциалом. Чем выше значение потенциала, тем активнее металл и сильнее его реакция с раствором соли.
В таблице представлены только некоторые из наиболее распространенных металлов и солей. Например, алюминий реагирует с растворами хлорида натрия, калия и магния, образуя соответствующие соли и выделяяся водород. Однако он не реагирует с растворами хлорида кальция или бария.
Таблица взаимодействия металлов с растворами солей является основой для понимания химических реакций и позволяет определить, какие металлы могут использоваться в различных процессах и промышленных производствах. Эти данные также полезны для проведения химических экспериментов и научных исследований.
Вопрос-ответ

Какие металлы взаимодействуют с растворами солей?
Различные металлы могут взаимодействовать с растворами солей в зависимости от их химической активности. Например, активные металлы, такие как натрий, калий и алюминий, легко реагируют с растворами солей и образуют ионы металла в растворе. Более инертные металлы, такие как золото и платина, обычно не реагируют с растворами солей.
Какие реакции происходят при взаимодействии металлов с растворами солей?
При взаимодействии металлов с растворами солей могут происходить различные реакции, такие как обмен ионами, образование осадков и растворение металла. Например, при смешивании раствора соли меди (CuSO4) с раствором цинка (ZnSO4) происходит обмен ионами и образуется осадок цинка (Zn) и раствор меди (CuSO4). Это реакция двойной замены.
Какие факторы влияют на взаимодействие металлов с растворами солей?
Взаимодействие металлов с растворами солей может зависеть от различных факторов. Один из ключевых факторов - активность металла. Более активные металлы легко реагируют с растворами солей, тогда как менее активные металлы могут быть инертными. Также влияние оказывает концентрация раствора и температура реакции.
Какие металлы реагируют с растворами солей и образуют водород?
Некоторые металлы, такие как алюминий, цинк и железо, могут реагировать с растворами солей и образовывать гидроген. Например, при взаимодействии цинка (Zn) с раствором соли серной кислоты (H2SO4) образуется водород и сульфат цинка (ZnSO4).
Может ли реакция металлов с растворами солей спровоцировать кислотное или щелочное окисление?
Да, реакция металлов с растворами солей может привести к образованию кислотных или щелочных окислений, в зависимости от химических свойств металлов и солей, участвующих в реакции. Например, реакция металла натрия (Na) с раствором соли фосфорной кислоты (H3PO4) приводит к образованию щелочного окисления и фосфата натрия (Na3PO4).
