Кислоты солей являются мощными химическими веществами, которые могут оказывать сильное влияние на металлы. Взаимодействие кислоты с металлом происходит в определенных условиях, которые определяют результат данного химического процесса.
Одной из важных характеристик взаимодействия металла с кислотой является их электрохимический потенциал. Разность электрохимических потенциалов между металлом и кислотой определяет скорость и интенсивность реакции. Если электрохимический потенциал металла выше, то взаимодействие происходит более активно, и металл может полностью раствориться в кислоте.
Однако, влияние кислоты на металл может проявляться не только в виде растворения. Некоторые металлы могут проявлять способность формировать защитную пленку на своей поверхности, которая предотвращает дальнейшее взаимодействие с кислотой. Такие процессы называются пассивацией и являются эффективным способом защиты металла от коррозии.
Изучение взаимодействия кислоты с металлами является важной задачей в области химии и материаловедения. Понимание условий и результатов взаимодействия помогает разработать новые материалы с повышенной стойкостью к химическим агентам и оптимизировать процессы производства и эксплуатации различных металлических изделий.
Соли кислот и их влияние на металлы
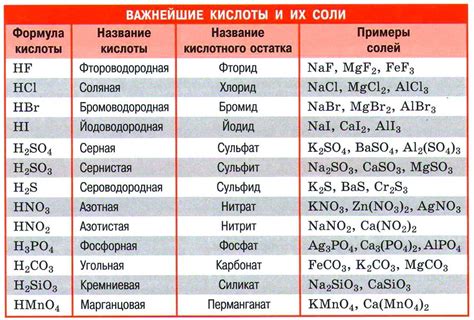
Соли кислот представляют собой химические вещества, состоящие из металла и кислотного остатка. Взаимодействие солей кислот с металлами имеет важное значение в различных процессах и технологиях. Контакт соляного раствора с металлами может вызывать различные реакции, которые зависят от конкретной пары металл-соль кислоты.
Первым типом взаимодействия является окислительное действие солей кислот на металлы. Некоторые металлы могут окисляться под влиянием солей кислот с образованием соответствующего оксида. Например, при взаимодействии соляной кислоты с железом образуется хлорид железа(III) и образующийся водород может выделяться в виде пузырьков.
Вторым типом реакций является растворение металлов в соляных растворах. Некоторые металлы могут растворяться под действием солей кислот с образованием ионов металла в растворе. Например, цинк растворяется в растворе серной кислоты, при этом образуются сульфат цинка и выделяется водород.
Третий тип взаимодействий состоит в обратных реакциях, когда соли кислот выделяют осажденный металл. Это может происходить при добавлении растворов солей оснований к соляным растворам, что приводит к образованию осадков металлов. Например, при взаимодействии хлорида натрия с латунью (сплав меди и цинка) образуется осадок цинка.
Итак, взаимодействие солей кислот с металлами может вызывать различные химические реакции, в результате которых образуются новые вещества или происходит растворение металлов. Эти процессы широко используются в различных областях промышленности и науки.
Условия взаимодействия

Взаимодействие металлов с кислотами и солями может происходить только в присутствии влаги или водных растворов. Вода является необходимым компонентом химических реакций между металлами и кислотами.
В зависимости от химической активности металла и его положения в ряду активности, различают условия, при которых взаимодействие происходит.
- Для активных металлов, таких как натрий, калий, реакция с кислотами происходит уже при комнатной температуре и в простых условиях, без необходимости нагрева.
- Для менее активных металлов, таких как медь или железо, реакция может происходить только при повышенных температурах и при наличии катализатора.
- Для пассивных металлов, таких как золото или платина, реакция с кислотами почти не происходит даже при высоких температурах.
Также важным условием взаимодействия является концентрация реагентов. Чем выше концентрация кислоты или соли, тем активнее может быть реакция с металлами.
В результате взаимодействия металла с кислотой или солью образуется химическое соединение, называемое соляной или кислотной солью. Реакционные продукты могут быть различными в зависимости от типа металла и кислоты или соли, а также условий взаимодействия.
Результаты взаимодействия
В результате взаимодействия кислоты с металлами может происходить различные химические реакции, которые влияют на их свойства и состояние.
При реакции сильной кислоты, например, соляной кислоты (HCl), с некоторыми металлами, такими как железо (Fe) или алюминий (Al), происходит выделение водорода (H2). Это происходит из-за разрушения металлической структуры и образования ионов металла, которые вступают в реакцию с водородными ионами, образуя газ.
Также, при взаимодействии кислоты с металлами, может образоваться соль. Например, при реакции серной кислоты (H2SO4) с натрием (Na) образуется сульфат натрия (Na2SO4). Это связано с тем, что ионы натрия замещают ионы водорода в кислоте и образуют соль.
Кроме того, некоторые металлы могут реагировать с кислотой, образуя осадок или выпадение нерастворимого соединения. Например, при реакции хлороводородной (HCl) кислоты с серебром (Ag) образуется хлорид серебра (AgCl), который является нерастворимой солью и выпадает в виде белого осадка.
В общем, результаты взаимодействия кислоты с металлами зависят от конкретной кислоты и металла, и могут быть разнообразными - от выделения газа до образования солей или осадков.
Вопрос-ответ

Какие металлы реагируют с кислотами?
С кислотами реагируют различные металлы, включая щелочные и щелочноземельные металлы, а также некоторые переходные металлы. Например, активные металлы, такие как натрий (Na), калий (K) и цезий (Cs), реагируют сильно сильно с кислотами, образуя соли и выделяя водород. В то же время, некоторые металлы, такие как золото (Au) и платина (Pt), не реагируют с обычными кислотами.
Какое влияние оказывает кислота на металл?
Кислоты могут оказывать различное влияние на металлы. В зависимости от характеристик кислоты и условий реакции, могут происходить различные результаты. Например, сильные кислоты, такие как соляная кислота (HCl) и серная кислота (H2SO4), способны разрушать или растворять металлы. Слабые кислоты, такие как уксусная кислота (CH3COOH) и лимонная кислота (C6H8O7), обычно не вызывают серьезных изменений в металлах. Взаимодействие с кислотами может вызывать окисление, выделение водорода, образование солей и другие реакции.
